融合STEM理念促进认识方式发展的主题式学习
作者: 王星 乔滕瑛 巧汪 纪苗 李晶
摘要:以“乙烷脱氢制乙烯工艺发展研究”为主题,融合STEM理念,开展高中化学主题式学习。通过完成“乙烷热裂解制乙烯”、“乙烷蒸汽裂解制乙烯”、“乙烷催化氧化脱氢制乙烯”等3个子任务,巩固化学反应与能量、化学反应速率、化学平衡等核心知识,发展化学学科能力和工程思维,形成化工生产三维认知模型。
关键词:主题式学习;认识方式;乙烷;乙烯;STEM
1主题价值分析
主题式学习以学生为主体,让学生在真实的问题情境中实践,并在探究和解决问题的过程中获得基本知识和技能、关键能力和必备品格[1]。将主题确定为“乙烷脱氢制乙烯工艺发展研究”,主要是因为该主题具有如下教学价值功能:
(1)源于生产实际。相较石脑油裂解制乙烯、煤基路线制乙烯,乙烷脱氢制乙烯具有工艺流程短、副产物含量少、乙烯收率大、投资小成本低、能耗低等优点,是最具发展潜力的工艺路线之一[2],吻合“真实情境下的问题解决”。
(2)建构认识角度。本主题与高中化学选择性必修1“化学反应原理”密切相关,通过对有关科技文献的检索,以“乙烷热裂解制乙烯→乙烷蒸汽裂解制乙烯→乙烷催化氧化脱氢制乙烯”作为教学主线,要求从能量、方向、限度、速率、历程等角度研究工业核心反应,从调控反应速率、提高反应转化率等方面综合分析反应条件,使得知识关联结构化、认识思路结构化。
(3)融合STEM理念。“乙烷脱氢制乙烯工艺发展研究”主题综合运用化学热力学和化学动力学等科学原理(S)实现物质转化,呈现乙烷热裂解、乙烷蒸汽裂解、乙烷催化氧化脱氢等制乙烯技术手段(T),渗透创造性思维、系统性思维、权衡性思维、价值性思维等工程思维(E)[3],进行图表数据的计算与深度分析(M),解决乙烷脱氢制乙烯的真实问题。
2学习目标
该主题教学可置于人教版教材选择性必修1第二章学习之后,此时的学生已知化学反应速率、化学平衡、化学反应的方向、化学反应的调控等知识内容。根据课标相应内容要求和学业要求,通过该主题的学习达到如下目标:
(1)能运用化学反应的方向、速率、限度等原理综合分析有关化学反应,提出有效控制反应条件的措施;
(2)能运用化学反应原理对数据、图表等科研证据进行分析推理,选择、优化工艺条件,形成从限度、速率、能耗等多角度综合调控化学反应和化工生产条件的认识模型;
(3)能够评价分析乙烷脱氢制乙烯各工艺的优劣,体会化学反应原理的社会价值和应用价值,形成“绿色化学”的观念。
3学习任务及教学流程
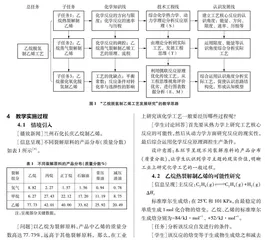
以“乙烷脱氢制乙烯工艺发展研究”作为总任务,经学生讨论拆解为三个递进式子任务,以问题为驱动,以活动为载体,在真实情境中发展学生的化学学科能力和工程思维。三个子任务、化学知识线、技术工程线及认识发展线如图1所示。
4教学实施过程
4.1 情境引入
【播放新闻】兰州石化长庆乙烷制乙烯。
【信息呈现】不同裂解原料的产品分布(质量分数)见表1所示[4]。
【问题】以乙烷为裂解原料,产品中乙烯的质量分数高达77.73%,远高于其它裂解原料。那么,在工业上研究该化学工艺一般要经历哪些过程呢?
【学生讨论回答】首先要从热力学上研究工艺核心反应的可能性,然后从动力学方面研究反应的现实性,最后综合运用化学反应原理调控生产条件。
设计意图:本环节呈现不同裂解原料的产品分布(质量分数),让学生认识到学习主题的现实价值,明晰工业上研究化学工艺一般要经历的过程。
4.2 乙烷热裂解制乙烯的可能性研究
【信息呈现】主反应:C2H6(g)C2H4(g)+H2(g) ΔH1
标准摩尔生成焓:在25 ℃和101 KPa,由最稳定的单质生成1 mol 化合物的焓变。乙烷、乙烯的标准摩尔生成焓分别为-84/kJ·mol-1、+52/kJ·mol-1。
【任务】分析该反应自发进行的条件。
【学生】该反应的焓变等于生成物生成焓之和减去反应物生成焓之和,ΔH1= +136kJ·mol-1 ,且ΔS>0,高温自发。
【提问】反应能自发进行,是否就能应用于工业生产?
【学生】还需考虑反应的限度、速率。
【教师】据资料可知,平衡常数数值不大,反应进行的程度不大。
【信息呈现】乙烷脱氢制乙烯的平衡常数见表2所示。
【教师】除了热力学,还要从动力学方面研究反应速率和反应机理。烷烃的裂解是自由基机理,科学家利用分子模拟软件计算得到乙烷热裂解可能发生的基元反应及对应的活化能。
【信息呈现】乙烷裂解中各基元反应及对应活化能如表3所示:
【任务】根据上述信息推测乙烷热裂解自由基反应的主要路径。
【学生讨论回答】开始阶段,反应温度低,未达到C-C、C-H键断键温度。随温度升高,发生反应Ⅱ,生成的甲基自由基与乙烷发生链传递反应Ⅳ,生成甲烷和乙基自由基;乙基自由基分解生成乙烯和氢自由基;活泼的氢自由基迅速与乙烷反应生成氢气和乙基自由基,形成了可持续反应的链传递过程。随着链传递反应不断循环进行,乙烷不断减少,导致所需的氢自由基减少,氢自由基大量累积,链终止主要以氢自由基生成氢气为主。
【小结】反应特点:强吸热,Δn>0,限度小,低温速率慢,高温易发生副反应。
【子任务成果】工艺核心反应的认识角度,见图3所示。
设计意图:本环节遵从实际科研程序,首先从热力学、动力学两大维度研究乙烷热裂解制乙烯主反应的特点。主反应焓变的计算及反应机理的推测要求学生对信息进行摄取、加工,综合运用所学知识分析和解决实际问题。通过这一子任务,外显工艺核心反应的认识角度,形成结构化认识,明晰化学反应原理的重要价值。
4.3乙烷蒸汽裂解制乙烯
【任务】如果你是工程师,请优化反应条件实现“又快又多”这一目标。
【讨论归纳】(1)要有适宜的反应温度,不能过低也不能过高,过低速率慢且转化率低,过高副反应多、催化剂失活且能耗大;(2)开发高效催化剂,加快主反应速率,提高乙烯选择性;(3)通过物理分离方式减少生成物浓度;(4)压强和反应物浓度要适宜,根据实际情况来确定。
【教师】在实际生产中乙烷裂解通常采用传统的蒸汽裂解工艺,技术成熟。
【信息呈现】乙烷蒸汽裂解制乙烯工艺主要由3部分组成:热解、压缩、冷却和分离。热解是将大分子裂解成小分子的吸热过程,主要是在管式裂解炉中进行。在裂解炉中引入一定比例水蒸气与乙烷一起预热,预热后再加热到700~900℃高温下反应得到乙烯和其他副产物,见图4所示。
【提问】已知裂解反应在常压下进行,为何要掺入水蒸汽?
【讨论归纳】正反应为气体分子数增大的反应,保持压强不变,加入水蒸汽,容器体积应增大,等效为降低压强,平衡向正反应方向移动;水蒸汽能与积碳反应,提高催化剂的活性;作为载热体将热量传递给乙烷。
【追问】为何不采取负压操作?
【学生】易吸入空气发生爆炸。
【提问】为何要进行冷却?为何要脱酸性气体和干燥?
【学生】避免继续发生裂解反应(抑制裂解气二次反应);防止后续冷却时在装置内形成固态杂质和冰,导致设备堵塞。
【任务】假定从干燥塔分离出来的气体为C1~C4烃类气体,经过后续的冷凝、精馏等操作达到逐一分离的目的,填写括号内各馏分的碳数。
【学生】自下而上、自左向右分别为:C4、C1~C3、C2~C3、C1、C3、C2。
【子任务成果】工程思维的要素与分析视角,见图5所示。
设计意图:乙烷裂解目前通常采用蒸汽裂解工艺,本环节旨在理解蒸汽裂解工艺的原理、流程及优缺点等内容,与此同时发展学生从理论模型到工业化生产过程中所蕴含的工程思维。
4.4乙烷催化氧化脱氢制乙烯
【问题】蒸汽裂解可以提高乙烷的转化率和乙烯的产率,但存在哪些缺点?
【讨论归纳】反应温度高且需要耗费大量水蒸气,耗能高。
【信息呈现】偶联反应原理:若A+B=C+D的Δr≫0,给它偶联上一个有C(显然不是目标产物)参与又极易进行的反应,如C+E=F,Δr≪0。两式合并得A+B+E=D+F,其Δr值(代数值)大大减小,则根据总反应就有可能得到目标产物(反应式中的D)[8]。
【提问】依据偶联反应原理,如何优化乙烷制乙烯工艺?
【学生】可以通入氧气实现氧化脱氢,既可以提高反应限度又可以降低能耗。
【新闻】新型乙烷氧化脱氢制乙烯催化剂问世[9]。
【信息呈现】2H2(g)+O2(g)2H2O(g) ΔH3= -483.6kJ·mol-1 =1080;
乙烷—氧气催化氧化工艺主反应为:2C2H6(g)+O2(g)2C2H4(g)+2H2O(g)。
【任务】结合信息及工艺主反应,评价该工艺的优缺点。
【讨论归纳】优点:强放热反应,无需外界供热,节约能源;反应限度大,几乎可以完全反应,热力学上有利;产物易于分离;不存在积碳问题。缺点:氧和烷烃及产物烯烃之间可发生很多副反应,产生CO、CO2及含氧的有机化合物如醇、醛、酸等;反应混合物可能会引发爆炸,要关注爆炸极限;反应放出大量热,可能会使催化剂失效;在脱氢反应中,副产物H2是一种宝贵的能源,但在氧化脱氢反应中不产生H2。
【过渡】既然氧气的氧化性过强,那就要寻找合适的弱氧化剂。
【信息呈现】乙烷-二氧化碳催化氧化制乙烯,主要发生如下两个反应: