课程思政理念下融合制盐发展历程的教学实践
作者: 黄瑾 汪秋英 张小亮 朱坤
摘 要: 以“用化学沉淀法去除粗盐中的杂质离子”教学为例,在课程思政理念下融合制盐史的发展为情境线索,充分挖掘传统文化的学科价值,引导学生在分析素材的同时初建、修正、完善物质分离提纯的一般模型,通过任务驱动及实验方案实施使学生切身体会除杂的过程,在数字化实验定量视角下结合定性分析除杂过程中的宏微变化,使思政与教学同向并行。
关键词: 课程思政; 教学设计; 制盐史; 数字化实验; 传统文化
文章编号: 1005-6629(2024)11-0036-07
中图分类号: G633.8
文献标识码: B
1 问题的提出
习近平总书记在2018年全国教育大会上提出“要坚持把立德树人作为教育的根本任务”,课程思政则是落实这一根本任务的重要途径[1]。课程思政是指在各学科课程中,充分利用好课堂教学的主渠道作用,努力发掘课程本身所蕴含的思想政治教育元素,坚持有机融合的原则,在系统、科学地进行知识讲授的过程中,有意识地开展理论传播、思想引领、价值引导、精神塑造和情感激发的教育方式[2]。《普通高中化学课程标准(2017年版2020年修订)》(以下简称“课标”)[3]指出,要“有机融入社会主义核心价值观、中华优秀传统文化、革命文化和社会主义先进文化教育内容”,在化学课堂中如何呈现部分化学知识背后的中华意蕴,将合适的思政素材融入课堂教学是值得探索的问题。
2 融入课程思政的高中化学教学现状分析
近五年,课程思政理念逐步由高校渗透到中小学。通过文献检索、分析以及观摩优质课视频发现,课程思政的身影也更加频繁地出现在高中化学教学当中。从课程思政素材的来源来看,部分高中教师或借助教材中的栏目内容如“化学与职业”[4],或结合中华优秀传统文化如酿酒[5]、化工生产如合成氨工业[6]来进行教学。但在众多课例中不乏出现思政板块与教学板块割裂以及思政素材挖掘深度不够的情况,使得课程思政只是浅层地浮于表面,未能真正发挥育人作用,主要原因在于教师对课程思政理念的理解程度不深、思政素材与教学的融合点难以把握[7]以及思政教学评价体系的欠缺[8]。其中,将思政素材与教学内容有效融合是构建学科育人课堂的关键。笔者将以人教版高中化学必修第二册“用化学沉淀法去除粗盐中的杂质离子”为例,进行设计、实践与反思。
3 “用化学沉淀法去除粗盐中的杂质离子”教学实例
3.1 教学主题分析
“用化学沉淀法去除粗盐中的杂质离子”作为学生必做的实验内容,“课标”要求能利用典型代表物的性质和反应,设计常见物质制备、分离、提纯、检验等简单任务的方案。在其他版本教材中,鲁科版将该内容纳入离子反应的应用,以“活动·探究”栏目“食盐的精制”呈现;苏教版则将其作为“海洋化学资源的综合利用”单元中的第一个板块,突出化学方法在资源利用中的价值。
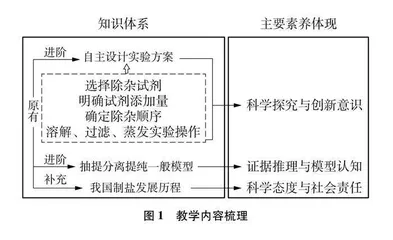
文献分析发现,一线教师在教授该内容时大多注重除杂试剂的选择、添加量及顺序的确定,学生只能单一理解粗盐的分离提纯,无法对分离提纯模型进行系统性的学习、理解,遇到陌生情境存在分析以及迁移应用上的困难;或基于粗盐提纯构建多组分混合体系的除杂模型,未挖掘蕴含于粗盐提纯背后的思政意蕴。基于以上考量,将人教版中的内容进行梳理进阶并补充我国制盐发展历程,分析其学科核心素养的落脚点,见图1。
3.2 思政素材与育人价值的链接
在查阅书籍《范旭东企业集团历史资料汇编——久大精盐公司专辑(上下册)》《四川盐法志》、视频资料、文献后,选取我国千年盐都四川自贡的古法制盐,以及1914年在天津创办、1938年因战况迁址自贡的久大精盐公司近现代、当代制盐发展等历史资源为思政素材,构建古代、近现代、当代为时间线的制盐发展史,突出情境的整体性、衔接性以及课程思政要素的渗透,目的在于使设计实验方案、物质分离提纯的一般模型等知识结构化的同时,发挥学科的育人功能。具体思政素材及育人价值见表1。
3.3 教学设计与思考
3.3.1 教学目标
本课题适宜开设在硫酸根离子的检验学习完成后,或作为章末实验活动,此时学生已基本了解溶解、过滤、蒸发的操作要求,学习了元素及其化合物基本性质,具备运用已有知识检验常见离子的能力。教学目标如下:
(1) 能够在古法制盐方法步骤基础上初步建立物质分离提纯模型,体会化学与生产的联系;
(2) 能够在确定除杂方案基础上实施实验方案,熟悉溶解、过滤、蒸发实验操作,发展严谨的科学态度和动手操作的能力;
(3) 能够在理解各步骤作用基础上修正、完善分离提纯模型并迁移应用,在思维结构化的同时发展证据推理与模型认知的核心素养;
(4) 能够在了解工艺的更迭创新及实业家范旭东、技术家肖家干的事迹后,感受技术进步给国家带来的影响,体会科学家的贡献,培养家国情怀。
3.3.2 教学流程图
在确定教学情境后,依据教学目标设计了连续2课时的教学活动:第1课时任务为了解古、近现代制盐历程,设计粗盐提纯方案;第2课时任务为实施实验方案,完善一般模型。本文以林崇德“构建中国化的学生发展核心素养”[9]一文为参考,选取其中符合化学学科特色的描述为思政元素,结合表1设计教学流程如图2所示。
3.4 教学过程实录
3.4.1 走进古法制盐,初建一般模型
[课堂导入]请看图片:超市货架上摆放的盐,它有着“百味之首”的称号。
[教师讲授]对比当代与古代的盐,呈现《天工开物》对盐的描述:“口之于味也,辛酸甘苦经年绝一无恙,独食盐禁戒旬日,则缚鸡胜匹、倦怠俨然。”如何得到盐呢?
[学生交流]分析古文含义,感受盐对生活的重要性并提出想法:海水晒盐。
[教师评价]该方法更适合沿海城市。播放视频《自贡盐井——传承千年的采盐术》,请同学们注意千年盐都自贡古法制盐的原料及步骤。
[学生描述]盐水(原料)-煮-盐结晶过程;联想“煮”至“蒸发”的实验方法。初步建构物质分离提纯的一般模型:原料-提纯-产物。
[资料卡片]“自贡井盐含有Ba2+,食者会出现‘软病’;山西池盐含有Na2SO4、 MgSO4,食之则味苦;若粗盐中含有MgSO4·7H2O,即泻盐,会导致腹泻”。
[学生概括]粗盐不能直接食用,对健康有碍。
[教师讲授]古人也意识到这个问题,在《四川盐法志》中记载:当煮盐接近于饱和时,“即入豆汁澄之,又煮许时,渣滓皆浮聚於面,隨挹出,又入豆汁二三次,渣净水澄”[10]。古人借助豆汁的胶体性质及其成分蛋白质使盐水澄清、提高品质。
3.4.2 分析近现代制盐,修正一般模型
[教师引导]近代,为了满足人们对盐的需求量和品质要求,我国民族化工之父范旭东在了解欧美制盐方法后,1914年于天津创办了久大精盐公司。他夜以继日依靠简陋的设备反复实验,克服技术、条件的困难生产出了中国人的第一包精盐,氯化钠含量由50%升高到了90%,摘掉了中华民族“吃土民族”的帽子。下面我们来看看他是如何做的。
[资料卡片]久大创办最初两年的精盐制法:“使粗盐溶解成饱和之盐卤,再通过沙板数层,滤净泥渣流入澄清池。池内有石灰乳少许,可使铁化合物沉淀于池底。[11]”
[学生]将粗盐溶解后过滤,用Ca(OH)2溶液使杂质Fe3+沉淀除去:
Fe3++3OH-Fe(OH)3↓
[学生评价]但依据除杂原则“不增、不减、易分、复原”,增加了其他的杂质离子,需要改进。
[任务驱动]若你是粗盐提纯的工艺设计师,需对含Ca2+、 Mg2+、 SO2-4的粗盐进行除杂,请遵循除杂原则并以资料卡片所示实验流程图(见图3)表示。
[学生设计方案]独立思考后讨论,小组汇报分享见图4。
[教师评价]多数同学按图3框架设计了流程,但部分同学遗漏对原料的处理。随着我国纯碱工业的崛起,久大精盐公司在1934年改进了精盐制法:“利用纯碱溶液去其不纯物质Mg2+、 Ca2+,……导入沸卤锅内再导入烤盐机内,烘烤之”。正是这一改进使得久大精盐的NaCl含量达到了95%[12],开启了中国盐业界的新纪元。请结合久大制盐方法,说说除杂想法。
[学生发言]除去Ca2+用Na2CO3溶液;除去Mg2+用Na2CO3溶液或NaOH溶液;除去SO2-4用BaCl2溶液。要添加适量、过量的除杂试剂。
[教师追问]除去Mg2+的试剂理论上都合适,是否有最优选?结合资料判断。
[资料卡片]当溶液中剩余离子浓度为1.0×10-5mol/L时,认为该离子沉淀完全。当Mg2+浓度为1.0×10-5mol/L时,所需CO2-3的浓度为0.68mol/L、 OH-的浓度为7.49×10-4mol/L。
[学生分析]Mg2+用NaOH溶液除去更合适,因为在溶液同浓度的情况下,用Na2CO3溶液来除去Mg2+需要更多试剂,会造成试剂的浪费。
[教师提问]这很符合“绿色化学”的理念,那么除杂试剂添加多少呢?
[学生讨论]过量,因为要确保杂质离子全部除去。为确定试剂添加过量,要在加入除杂试剂静置后向上层清液再滴加除杂试剂,若没有沉淀产生就是过量。
[学生反馈]书写除杂过程中反应的化学方程式。
[教师提问]由于杂质离子浓度未知,为确保全部去除要添加过量试剂。如何确定试剂添加过量呢?
[学生思考]加入除杂试剂后向上层清液再滴加除杂试剂,没有沉淀就是过量。
[数字化实验演示]借助电导率传感器来确定过量除杂溶液的体积。为使得电导率在可测范围内,将5g粗盐溶于20mL蒸馏水溶解过滤后稀释20倍,取40mL向其中滴加0.01mol/L BaCl2溶液。数据处理后溶液的电导率变化曲线见图5。
[教师引导]请从宏、微视角分析曲线成因。
[学生观察实验、分析说明]宏观现象:随着BaCl2溶液的滴加烧杯内溶液逐渐浑浊,电导率曲线先下降再上升;微观分析:Ba2+与SO2-4反应生成了BaSO4沉淀,降低了溶液中的离子浓度使得曲线下降,最低点是杂质离子SO2-4完全去除;随着除杂试剂过量,溶液中的离子浓度会增加,形成了升高的电导率曲线。
[教师讲解]久大是通过浓度关系来添加适量除杂试剂的,即“用适量石灰处理浓度相宜之盐卤,则因硫磺浓度间之关系……”[13]。现在制盐工业的做法是用离子分析仪确定杂质种类,依据杂质与除杂试剂分子量的比值、除杂试剂纯度、过剩系数Y、处理量G等精确计算、定量添加。
[教师提问]试剂的添加顺序如何?
[学生讨论]BaCl2溶液要先于Na2CO3溶液添加,否则会引入新杂质离子Ba2+;并且当除杂试剂均过量时会有CO2-3、 OH-剩余,因此过滤后再添加盐酸至无气泡冒出,且溶液为中性。
[教师评价]没错,同学们考虑得非常全面,但为保证OH-除尽,最好使pH≤6。
[资料卡片]补充久大制盐方法:1945年,久大利用晒卤台对盐水进行加速浓缩,并通过改良盐田使得产出的精盐NaCl含量达到了98%;再用洗涤方法,使纯度高达99%
[14]。
[教师讲解]讲解洗涤结晶/沉淀的目的、原则、选择洗涤剂的方法。为粗盐精制提供多种洗涤剂:蒸馏水、酸、饱和NaCl溶液、NaOH溶液。
[学生判断]洗涤杂质沉淀时用蒸馏水;洗涤结晶时用饱和NaCl溶液。