促进“物质的量”概念本质理解的教学设计研究
作者: 姜显光 王明月
摘要: “物质的量”是高中化学的重要概念,是宏观与微观联系的重要桥梁。基于化学史实,追寻科学家的思维方式和方法,促进概念本质理解。以概念的历史动态演变过程为线索,追随化学家的脚步去探寻知识发展的历史脉络,了解概念提出的背景和意义,深刻体会概念的内涵和价值,感受科学家严谨求实的科学态度以及追求真理的科学精神,发展学生的化学学科核心素养。
关键词: 高中化学; 物质的量; 化学史; 概念本质; 教学设计
文章编号: 1005-6629(2023)09-0051-05 中图分类号: G633.8 文献标识码: B
“物质的量”是高中化学核心概念之一,是化学宏观与微观“定量”联结的桥梁。化学科学的发展历史证明,只有深入到微观领域,化学才走上了科学的发展道路。然而人类无法直接用肉眼或仪器观察微观世界[1],“物质的量”概念的引入,把化学宏观与微观联结在一起。但“物质的量”概念一般难以理解,相关知识内容错综复杂,因此成为高中化学的教学难点。
促进概念本质理解是落实新一轮基础教育课程改革的目标,是发展化学学科核心素养的重要途径。诸多一线教师开展了“物质的量”概念的教学研究,构建了多种课堂教学案例。例如,基于认知发展理论教学、基于问题驱动的项目式教学、基于具身认知理论的教学等。以化学史为情境素材促进概念本质理解是核心素养导向化学课堂教学的重要策略。学生通过化学史实进行知识学习、概念建构,才能真正懂得“学什么”“为什么学”。本文旨在通过化学史实教学促进“物质的量”概念本质理解,促使学生感悟化学学科思想,体会化学学科思维方式和方法。
1 教学主题内容及教学现状分析
本节课的内容位于人民教育出版社《普通高中教科书·化学(必修·第一册)》[2]第二章“海水中的重要元素——钠和氯”中第三节“物质的量”。本节课内容主要包括“物质的量”“摩尔”“阿伏伽德罗常数”“摩尔质量”及各物理量之间的相互转换计算。
在初中阶段,学生已经学习了原子、分子等微观粒子的基本知识,对道尔顿原子学说、阿伏伽德罗分子学说有一定的了解。在高中阶段,学生已经学习了离子反应、氧化还原反应,因此对微观粒子并不陌生。“物质的量”是学习气体摩尔体积、物质的量浓度等内容的基础,并贯穿于高中化学学习全过程,尤其在化学计算中处于重要的位置[3]。同时,“物质的量”将微观粒子与可观测、可称量的宏观物质联系起来,被称为化学宏微世界联系的桥梁。
在教学实践中,“物质的量”教学中存在如下几方面问题:(1)灌输式教学。在实际教学中,“灌输式”教学较为常见,学生往往是被动地、机械地记忆概念以及公式转换[4]。由于学生单纯地记忆大量概念,不理解引入“物质的量”“摩尔”等概念的必要性,因此无法理解概念本质。加上本单元概念颇多,很容易混淆。(2)机械地引入科学概念。部分教师直接以国际单位制中的七个基本物理量引入“物质的量”概念。虽然学生知道长度、质量等宏观物理量,但是学生对其微观内涵并不理解。(3)缺乏相关史实资料的阅读和学习,造成对概念本质理解的缺失。从19世纪至今,科学家们先后提出了原子学说、分子学说、摩尔、阿伏伽德罗常数等假说或概念,最后才提出“物质的量”概念。但是现实课堂教学却是逆向进行的,大多数教师从“物质的量”概念讲起,再引出摩尔、阿伏伽德罗常数等概念,导致学生认为摩尔等概念是“物质的量”概念的衍生品。解决上述问题的有效方法之一是将历史进行梳理,只有明晰当时概念变化的历史情境,才能真正明白情境中化学科学的理论、实践、决策的价值[5]。
2 教学思想
《普通高中化学课程标准(2017年版2020年修订)》提出的主旨理念是化学学科核心素养[6],“真实、具体的问题情境是学生化学学科核心素养形成和发展的重要平台,也为学生化学学科核心素养提供了真实的表现机会”[10]。在素养导向的化学教学设计时,教师要“关注化学理论的历史演进过程,结合理论模型发展中的重要事实和科学家的推理论证过程,引导学生认识化学理论的建立过程和思想方法”[7]。
追寻科学家的“脚步”,探寻科学家的思想方法,才能明确知识本质,解决实际问题。概念的产生有其特定的社会历史背景,学生了解概念的产生背景才能理解概念背后的价值。物质的量、摩尔、阿伏伽德罗常数等概念的产生及演变贯穿着整个近代化学发展历史,凝结着无数科学家的思想和方法,蕴含着丰富的科学价值。1803年,道尔顿提出化学意义上的原子概念,1811年,阿伏伽德罗提出分子假说。原子、分子概念的提出标志着化学家对化学微观世界的认识取得了突破。1860年,第一次化学家国际会议在德国卡尔斯鲁厄举行,康尼查罗运用历史与逻辑相一致的思想和方法,论证了原子和分子间的区别与联系。1865年,洛施密特以阿伏伽德罗的猜想为基础,测定出一定容积的气体所含的分子数。1900年奥斯特瓦尔德提出“摩尔”概念。1908年,佩兰等人陆续测定出了阿伏伽德罗常数的近似值。1971年国际计量大会决议“物质的量”作为国际单位制中的一个基本物理量。自“摩尔”“物质的量”提出以后,科学家们通过物质的量间接地测量物质的微观粒子数目,将宏观世界与微观世界紧密地联系起来。
3 教学目标
(1) 通过阅读化学史实资料,了解科学家在认识微观世界过程中遭遇的困境,感受科学发展进步的曲折与艰辛。
(2) 通过阅读分子、摩尔、阿伏伽德罗常数、物质的量等概念的相关化学史实,建构化学宏观与化学微观间的关联,形成严谨求实的科学态度,勇于追求真理的科学精神。
(3) 通过宏观质量与微观粒子质量间关系的计算,确立物质的量作为宏观质量与微观粒子数之间定量联系的桥梁功能。
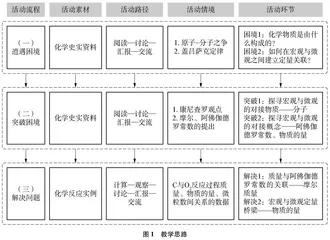
4 教学思路
教学思路如图1所示。根据所提供的学习资料,通过小组合作进行交流讨论,完成教学流程。
4.1 遭遇困境
宏观辨识与微观探析是化学学科核心素养之一,宏观、微观是认识化学的视角。明确科学家在试图将宏观和微观建立关联时遇到的困境是理解知识本质的基础或前提。
4.1.1 困境1:化学物质是由什么构成的?
问题1: 化学物质构成问题曾经困扰了科学家多年,请阅读学习资料1,看科学家遇到了什么问题?
学习资料1: 1803年,英国科学家道尔顿提出化学意义上的原子概念,认为原子是构成物质的基本粒子。1811年,意大利物理学家阿伏伽德罗提出分子假说,认为分子是构成物质的基本粒子,并且推导出了一些元素原子量和化合物分子式。这导致在后面半个世纪的时间里,科学家一方面都运用原子理论解决问题,而另一方面又不信任它,甚至怀疑原子本身的存在。另外,分子假说由于与“电化二元论”相矛盾而未获承认。
问题2: 道尔顿的原子论、阿伏伽德罗的分子论是否解决了科学家长期关心的化学物质构成问题?原因是什么?
设计意图: 通过阅读学习资料1了解化学物质构成的历史争论,激发学生对化学微观认识的兴趣。启发学生解决化学微观世界的构成层次问题,能够有效地解决宏观物质与微观粒子间的对接问题。问题1引导学生进行资料阅读,体会对化学微观认识不足导致在解决实际问题时遇到的困难;问题2引领学生对学习资料1的内容进行深层理解,明确原子论和分子假说在研究物质构成问题时是存在缺陷的。由于化学微观世界构成层次不清晰,给科学家们带来困惑,因此在将化学宏观和微观建立关联时找不到“对接物质”。培养学生的阅读能力和分析能力。
4.1.2 困境2:如何在宏观与微观之间建立定量关联?
问题3: 科学家在将宏观与微观建立关联的研究中实验起到了至关重要的作用,请阅读学习资料2,科学家发现了什么规律?
学习资料2: 1805年,法国物理学家盖·吕萨克发现将氢气和氧气的混合气体通过电火花点燃后生成水,100体积的氧气总是和200体积的氢气相化合。随后盖·吕萨克进一步研究了其他气体物质间的相互反应,也存在这一反应规律。
问题4: 盖·吕萨克发现的比例关系与化学方程式中的哪些数值存在对应关系?
问题5: 这与初中用质量进行化学反应计算存在着怎样的关联?
设计意图: 学习资料2通过盖·吕萨克发现的实验规律,启发学生在实验规律、化学计量系数、质量之间的建立对应关系。问题3引导学生阅读学习资料2,提示学生阅读资料关注点是什么;问题4引领学生思考,将资料中的信息与已学知识建立关联,基于微观粒子数视角认识化学反应物质间的对应关系;问题5进一步引领学生思考,分子个数比与分子质量比之间的关系,为后面突破困境做铺垫。培养学生发现规律和新旧知识关联能力。
4.2 突破困境
4.2.1 突破1:探寻宏观与微观的对接物质——分子
问题1: 从尺度视角看,宏观物质摸得着、看得见,微观物质摸不着、看不见。道尔顿和阿伏伽德罗分别提出原子、分子是构成化学物质的基本粒子,那么宏观与微观的对接物质到底是原子还是分子呢?即哪个微观粒子能够反映宏观物质的性质?请阅读学习资料3。
学习资料3: 阿伏伽德罗分子假说在很长一段时间内未受到化学界和物理学界的重视。化学家们混淆使用当量、原子量和分子量等概念,而且化学式的表达也处于混乱状态。1860年,德国卡尔斯鲁厄举行了第一次化学家国际会议,意大利科学家康尼查罗通过印刷小册子的形式,指出测定原子量时,可以取氢分子的一半重量为一个单位,或规定氢分子的密度为2,这样所有的分子量都可以用某一单位重量来表示。并进一步提出近年来化学之进步,已经证实等体积的气体中无论是单质还是化合物,都含有相同数目的分子,但不一定含有相同数目的原子。科学家迈尔看到小册子后兴奋地说,“眼前的阴翳消失了,怀疑没有了,使我有一种安定的明确的感觉”[8]。
问题2: 迈尔为什么有了安定的明确的感觉?
设计意图: 学习资料3通过康尼查罗思想的重现,启发学生明确分子和原子之间的关系,确定分子是保持物质化学性质的基本粒子,为建立宏微关联找到了对接物质。问题1是在困境1的基础上提出,引导学生阅读学习资料3,找出宏观和微观的对接物质;问题2是借助迈尔的感慨,进一步思考、明确原子和分子之间的区别与联系。培养学生的阅读能力以及关键证据的提取能力。
4.2.2 突破2:探寻宏观与微观的对接概念——阿伏伽德罗常数、物质的量
问题3: 分子是保持物质化学性质的微观粒子。宏观上,可以用“质量”“体积”等概念对物质的数量进行描述;微观上,分子的质量、体积很小,而且数目庞大,如何利用质量、体积间接计算微观粒子数目呢?请阅读学习资料4。
学习资料4: 1811年,阿伏伽德罗发表论文提出“对于相等体积的任何气体,其中所含的分子数目是相等的,或者总是与它的体积成比例的”[9]。1865年,奥地利物理学家洛施密特根据分子运动论测得标准状态时1m3任何气体都含有2.6876×1025个分子,这为分子假说从定量角度提供了支持[10]。1900年,奥斯瓦尔德提出“摩尔”概念,在正常情况下,22414毫升任何气体分子数量为1摩尔[11]。1908~1909年,法国物理学家佩兰通过实验证实了分子的存在,并测得这个数值为7.5×1023,于1908年将1克分子量(在19世纪上半叶,克分子量、克原子量等概念都用来表达物质质量)体积中的分子数规定为1阿伏伽德罗常数(为纪念分子假说的提出者——阿伏伽德罗),1981年舍夫利德等人在对X射线做了改进之后测定出其近似值为6.02×1023,用符号NA表示,单位是mol-1[12]。