电极反应式书写的几项原则
作者: 但世辉 李茂炽
摘要: 以燃料电池电解质的四种类型(酸性、碱性、熔融碳酸盐、固体氧化物)电池电极反应式的书写为突破口,总结归纳书写电极反应式的“123原则”,并结合高考例题进行解法分析,将“123原则”推广应用到中学常见的各种类型装置,包括新型燃料电池、可充电电池和电解池中电极反应式的书写。
关键词: 燃料电池; 电极反应式; 相对化合价; 教学研讨
文章编号: 10056629(2022)01007405
中图分类号: G633.8
文献标识码: B
电极反应式的书写,包括化学电池(原电池、可充电电池、铅酸蓄电池、燃料电池等)、电解池、金属的腐蚀与防护等,属于高考中的高频考点,在具体的复习过程中,可以先将燃料电池单独分离出来进行小专题复
习,进而让学生全面掌握电极反应式的各种“技能包”,然后再逐渐推广至其他类型电池电极反应式的书写。以这一个点,总结出一条线,扩展至一个面,循序渐进,从而帮助学生熟练掌握不同类型的电极反应式的书写方法。
1 找到一个点——熟练掌握燃料电池电极反应式的书写
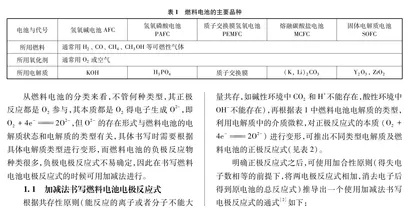
燃料电池是一种不经过燃烧,将燃料的化学能经过电化学反应直接转化为电能的装置,它也是按电化学原理即原电池工作原理进行设计的,从本质上来说也是氧化还原反应。由于燃料电池使用的燃料和氧化剂的种类不同,可将其分为不同的品种(见表1)[1],故而在不同品种的燃料电池中,电极反应式的书写就要随之变化。
从燃料电池的分类来看,不管何种类型,其正极反应都是O2参与,其本质都是O2得电子生成O2-,即O2+4e-2O2-,但O2-的存在形式与燃料电池的电解质状态和电解质的类型有关,具体书写时需要根据具体电解质类型进行变形,而燃料电池的负极反应物种类很多,负极电极反应式不易确定,因此在书写燃料电池电极反应式的时候可用加减法进行。
1.1 加减法书写燃料电池电极反应式
根据共存性原则(能反应的离子或者分子不能大量共存,如碱性环境中CO2和H+不能存在,酸性环境中OH-不能存在),再根据表1中燃料电池电解质的类型,利用电解质中的介质微粒,对正极反应式的本质(O2+4e-2O2-)进行变形,可推出不同类型电解质及燃料电池的正极反应式(见表2)。
明确正极反应式之后,可使用加合性原则(得失电子数相等的前提下,将两电极反应式相加,消去电子后得到原电池的总反应式)推导出一个使用加减法书写电极反应式的通式[2]如下:
电池总反应式: 还原剂+氧化剂+介质氧化产物+还原产物
正极反应式: 氧化剂+ne-+介质还原产物
负极反应式: 还原剂-ne-+介质氧化产物
其中介质可参加反应,也可不参加反应,其关键作用在于确保电极反应式的三大守恒(得失电子守恒、元素守恒、电荷守恒)。
1.1.1 电解质为酸性电解质溶液
例1 (2013高考新课标Ⅰ卷28题节选)二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。二甲醚直接燃料电池具有启动快、效率高等优点。若电解质为酸性,二甲醚直接燃料电池的负极反应式为 。
此电池电解质为酸性,根据共存性原则CO2可在酸性环境中存在,写出其总反应式: CH3OCH3+3O22CO2+3H2O。根据表2可知其正极反应式为O2+4H++4e-2H2O,再根据加合性原则保证上述反应式转移电子个数相等,需要将正极反应式系数扩大3倍,使用加减法很容易推出该电池的负极反应式: CH3OCH3+3H2O-12e-2CO2+12H+。
1.1.2 电解质为碱性电解质溶液
例2 (2020年高考江苏卷第20题节选)HCOOH燃料电池性能的装置如图1所示,
两电极区间用允许钾离子、氢离子通过的半透膜隔开。
电池负极电极反应式为 。
此装置电解质为碱性环境,根据表2可知正极反应式为O2+2H2O+4e-4OH-,碱性环境可由OH-来保证反应式中的电荷守恒和元素守恒,根据图示的反应物和生成物可推出总反应式为2HCOO-+O2+2OH-2HCO-3+2H2O,此时两个反应式电子转移个数均为4,满足加合性原则,使用加减法推知负极反应式为: HCOO-+2OH--2e-HCO-3+H2O。
1.1.3 电解质为熔融碳酸盐
例3 (2015年高考江苏卷第10题)一种熔融碳酸盐燃料电池原理示意如图2(脱水是立体图示,其余为剖面图示)。下列有关该电池的说法正确的是( )。
A. 反应CH4+H2O催化剂△3H2+CO,每消耗1mol CH4转移12mol电子
B. 电极A上H2参与的电极反应为: H2+2OH--2e-2H2O
C. 电池工作时,CO2-3向电极B移动
D. 电极B上发生的电极反应为: O2+2CO2+4e-2CO2-3
该原电池为熔融碳酸盐燃料电池,可使用的介质微粒是CO2-3,根据表2可直接推出D选项符合题意。
1.1.4 电解质为固体氧化物
例4 (2013年高考北京卷第26题节选)通过NOx传感器可监测NOx的含量,其工作原理示意图如图3所示,写出NiO电极的电极反应式: 。
该装置电解质为固体氧化物,根据共存性原则,O2-作为介质微粒可单独存在,根据表2可知其正极反应式为O2+4e-2O2-,再根据图示推出总反应式为2NO+O22NO2(转移的电子数也为4个),两式相减可得负极反应式为2NO-4e-+2O2-2NO2。
1.2 相对化合价法直接书写电极反应式
加减法间接书写电极反应式思路清晰但步骤较多,对于复杂的可燃物(有机物、肼等燃料)可使用相对化合价的方法(也有称氧化数法)标出中心元素的化合价: 根据电负性的概念,电负性较大的成键原子对键合电子的吸引力较大,使键合电子偏向该原子,导致其带部分负电荷,对应元素化合价为负值,反之,化合价为正值。在常见有机物的构成元素中,O的电负性(3.5)较大,H的电负性(2.1)最小,键合电子偏向O,导致O元素的化合价为负值,H元素的化合价为正值。因此可定义O为-2价,H为+1价,从而推导出C的化合价,计算出单位燃料被氧化后失去电子的总数,确定计量系数之比,结合电解质中的介质微粒,运用三大守恒直接书写电极反应式[3]。
以例2进行说明,使用加减法进行推断,必须先写出总反应式,然后相减,较为复杂。根据相对化合价的方法,对于HCOOH, O元素的电负性最大,将其化合价记为-2价,H元素的电负性最小,将其化合价记为+1价,由于化合价的代数和为0,可推知C元素为+2价,并且最终被氧化成+4价,试题中已经给出反应物(HCOO-)和生成物(HCO-3),使用OH-来补充至反应式中保证电荷守恒和元素守恒,推出负极反应式为HCOO-+2OH--2e-HCO-3+H2O。很明显,相对化合价法直接书写电极反应式更加简洁快速。
2 总结一条线——由燃料电池电极反应式的书写总结出一套原则
从上述燃料电池电极反应式的书写过程中可以发现,燃料电池电极反应式的书写对其他各种类型(化学电池、电解池等)电极反应式的书写具有很好的指导意义。由于燃料电池电解质环境(酸性、碱性、熔融盐、固体氧化物等)包括了中学常见的所有电解质环境,并且其正极反应物(氧气)较为固定等原因,根据燃料电池电极反应式的书写可归纳出一套成体系的原则(简称“123原则”),这个原则包括了书写电极反应式所用的所有原理和技巧,可运用在所有电极反应式的书写上。具体如下:
1个本质。燃料电池电极反应式的熟练书写有利于学生认清一个本质: 不管是何种电池(原电池或电解池)电极反应式的书写,其本质均是氧化还原反应原理的再运用,书写电极反应式就是对某个氧化还原反应进行二次拆分和组合,需要推导的就是相应的反应物和生成物以及转移的电子数。
2个原则。燃料电池电极反应式的熟练书写有利于掌握两个原则: 一是共存性原则,这是书写电极反应式时寻找反应物或生成物的基本依据,确保生成物的合理性。二是加合性原则,在电池三式(正极反应式、负极反应式、总反应式)转移电子个数相等的基础上进行加减,知二求一,避难求易。
3个守恒。燃料电池电极反应式的熟练书写有利于掌握三种守恒: 电子得失守恒、元素守恒、电荷守恒。在具体书写的过程中,需要灵活运用电解质中存在的介质微粒,包括H+、 OH-、 CO2-3、 O2-、 H2O等,而这些微粒在各种类型燃料电池的电解质中均有体现。这些微粒的系数可大可小,在反应式中的位置可左可右,也不一定都要参加反应,需要根据具体情况确保三大守恒即可。
在电极反应式书写的高考复习中,反复练习燃料电池电极反应式的书写,把上述“123原则”融入解题思路,进而在其他类型电池电极反应式的书写中熟练运用,往往可以以点带面、化繁为简(见图4)。
3 带出多个面——由燃料电池电极反应式书写的“123原则”解答各类题型
3.1 新型电池电极反应式的书写
在历年高考试题中,各类电池往往出现很多新面孔,这些试题借助于最新的科技知识来进行设计,比如太阳能电池、微生物燃料电池、新型锂电池等,不管电池有多新,其电极反应式的书写方法依然建立在“123原则”之上。
例5 (2018年高考江苏卷第3题)以葡萄糖为燃料的微生物燃料电池结构示意图如图5所示。关于该电池的叙述正确的是( )。
A. 该电池能够在高温下工作
B. 电池的负极反应为: C6H12O6+6H2O-24e-6CO2↑+24H+
C. 放电过程中,H+从正极区向负极区迁移
D. 在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO2气体22.4/6L
微生物燃料电池属于新型电池,其工作原理从本质上来讲依然属于氧化还原反应,遵循“123原则”。试题中的B选项是解答本题的关键,可使用加减法间接书写。首先根据题意可以确定电解质类型为酸性,用介质微粒H+来确保守恒,根据共存性原则,CO2可以在此环境下存在,写出总反应: C6H12O6+6O26CO2+6H2O(转移24个电子),由表2写出正极反应式: O2+4H++4e-2H2O,根据加合性原则,将正极反应式各微粒系数扩大6倍,然后相减便推知负极反应式: C6H12O6+6H2O-24e-6CO2↑+24H+。也可使用相对化合价方法直接书写负极电极反应式,先计算C6H12O6中的C为0价,转化为CO2需转移24个电子,酸性环境使用介质微粒H+来确保元素守恒和电荷守恒,也可推出电极反应式。
3.2 电解池电解反应式的书写
虽然在构成上,电解池和原电池区别很大,但在电极反应式的书写上,电解池和原电池类似,依然遵循“123原则”,在具体书写的过程中,灵活运用即可。
例6 (2019年高考江苏卷第20题节选)CO2的资源化利用能有效减少CO2排放,充分利用碳资源。电解法转化CO2可实现CO2资源化利用,原理示意图如图6所示。写出阴极CO2还原为HCOO-的电极反应式: 。
根据“123原则”,反应过程为酸性环境,使用H+来确定电极反应式中的电荷守恒和元素守恒,采用相对化合价法直接书写电极反应式,CO2中的C为+4价,HCOO-中的C为+2价,1mol CO2转化为HCOO-时转移2mol e-,最终可写出电极反应式: CO2+H++2e-HCOO-。