基于化学学科理解审视高中化学作业设计
作者: 陈雪霞 陈荣聪 张贤金 黄翠玉
摘要: 以电解质溶液导电能力(或电导率)的影响因素及变化曲线模型、浓硫酸性质应用的学科本原性问题提炼和实验现象的科学探究为例,结合具体习题或试题,基于化学学科理解的视角对部分教师知识理解上的问题进行剖析,提出优化高中化学作业设计的三点启示。
关键词: 化学学科理解; 作业设计; 真实情境; 导电能力; 数字实验
文章编号: 10056629(2022)09008406
中图分类号: G633.8
文献标识码: B
作为一线高中化学教师,平时在选编设计作业时,经常会遇到一些存在情境科学性和真实性问题的题目。所谓情境的科学性是指素材及其设问符合客观实际,实验材料、数据、结果可靠,能反映出事物的本质和内在规律等的情境[1]。所谓情境的真实性是指“人为优化”[2]后符合学生认知和发展且具有“正确导向”[3]的情境内容,强调具有素养发展可能的知识的真实存在和思维的真实发生[4]。化学学科作为一门科学学科,科学性和真实性是其内在要求。化学作业情境存在科学性和真实性问题有几个可能的原因: 一是基于学生的知识经验和认知能力,教材编写对某些比较复杂的化学知识进行了模糊表达[5],而教师却没有深度研究,存在认识和理解上的不足;二是基于先行者进行化学探索、实证推测时运用的实验手段和方法受限于理论水平或仪器技术水平,处理化学实验问题产生了结论偏差;三是基于教师对教学的浅层表达或个人经验,出现了或以偏概全、或简单迁移、或忽视细节、或专业匮乏等科学性错误[6]。这些情境缺乏科学性和真实性的题目不利于发展学生的化学学科核心素养,不宜再选编为作业。
提升作业情境的科学性和真实性,仅仅聚焦于教师专业知识水平的提升是不够的,而应站在更高的站位,通过增进教师的化学学科理解才能提升作业设计的质量。所谓化学学科理解是指教师对化学学科知识及其(具有化学学科特质的)思维方式和方法的一种本原性、结构化的认识[7]。要求教师对化学知识进行本原性思考,抽提出学科本原性问题,基于化学知识的学科功能,将化学知识关联起来,形成有机的整体[8]。教师对化学学科知识的内涵理解得越深刻,越容易从整体结构、系统方法、实践过程和思想观念等领悟学科特质[9]。
一线教师要提升高中化学作业设计的质量,一个重要的途径就是有意识地对已有的习题或试题进行深度研究,重点研究情境的科学性和真实性问题,以“情境问题”所涉及的知识为线索不断进行拷问,不断更新认知,有助于教师更为准确、深刻地理解知识,不断地增进教师的化学学科理解。本文尝试以电解质溶液导电能力(或电导率)的影响因素及变化曲线模型、浓硫酸性质应用的学科本原性问题提炼和实验现象的科学探究为例,结合具体习题或试题,基于化学学科理解的视角对部分教师知识理解上的问题进行剖析。基于研究,提出优化高中化学作业设计的三点具体启示。
1 结合习题或试题进行深度研究,增进教师的化学学科理解
1.1 电解质溶液导电能力(或电导率)的影响因素及变化曲线模型
高中化学学习中,导电性实验被应用于电解质及其强弱的区分和探究离子反应的本质。如关于导电性强弱的影响因素,常见的一道习题为:
把0.05mol NaOH固体分别加入到下列100mL液体中,溶液的导电性基本不变的是(参考答案: B)。
A. 自来水 B. 0.5mol·L-1的盐酸
C. 0.5mol·L-1的醋酸 D. 0.5mol·L-1的氨水
这道习题构建了溶液导电性与离子浓度关系的一般模型: 溶液中自由移动离子的浓度越大、离子所带的电荷数越多,溶液的导电性越强。上述模型属于知识立意浅层次的定性提炼,对导电实验缺乏深度实践。随着高考改革的深入,导电性实验试题不再局限于“离子浓度”和“离子电荷”等影响因素的考查,而是能力和素养立意,基于深度的定量实验,以真实有力的实证数据,探寻离子多维性质与溶液导电能力的关联。以下以2019年全国Ⅰ卷第11题和2020年全国Ⅰ卷第27题(2)为例。
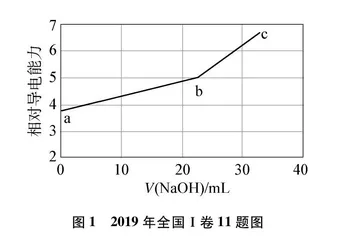
(2019年全国Ⅰ卷,11)NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10-3, Ka2=3.9×10-6)溶液,混合溶液的相对导电能力变化曲线如图1所示,其中b点为反应终点。下列叙述错误的是(参考答案: C)。
A. 混合溶液的导电能力与离子浓度和种类有关
B. Na+与A2-的导电能力之和大于HA-的
C. b点的混合溶液pH=7
D. c点的混合溶液中,c(Na+)>c(K+)>c(OH-)
该题以滴定过程混合溶液的相对导电能力变化曲线为载体,考查导电能力的影响因素、导电能力大小比较、特定反应比例点微粒浓度大小判断与比较等。选项B,有关不同微粒导电能力比较的考查,考生仅能从曲线图结合反应过程不同点溶质及浓度变化情况进行分析。a点的溶质为KHA,b点的溶质为KNaA,且随着溶液体积的增加,c(K+)减小,c(HA-)a大于c(A2-)b,结合图像,显然“Na+与A2-的导电能力之和大于HA-的”,故选项B正确。
部分教师及学生解释为: 离子所带电荷数增加(HA-→A2-)、离子半径和式量的减小(K+→Na+)是导电能力增加的原因。面对可能出现的化学学科理解窄化,即如“离子半径和式量越小,导电能力越强”,2020年全国Ⅰ卷命制了如下试题:
[2020年全国Ⅰ卷第27题(2)]电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据表1数据,盐桥中应选择 _______作为电解质。(参考答案: KCl)
该题以盐桥中电解质的选择为背景,考查离子共存及盐桥中电解质阴、阳离子选择的依据。虽然没有正面考查导电性强弱与离子电荷、离子半径和离子式量的关系,但给出的数据,纠正了该知识块的窄化理解:“离子半径和式量越小,导电能力越强”和“带2个单位电荷,导电能力是带1个单位电荷的2倍”。例证: Na+、 K+和Ca2+的电迁移率[u∞×108]分别为5.19、7.62和6.16[10](注: 试题数据与查阅数据不同,6.59[11]应为Ba2+的,Ca2+的数据6.16为计算所得),显然Na+的导电能力小于K+的,Ca2+的并不为Na+的2倍,且小于K+的。
理论依据: 电解质溶液导电是由溶液中离子定向移动引起的,而离子在电场中的运动速度,与离子的本性(如离子所带电荷、离子半径、离子的水化程度等)、离子的电迁移率(即离子淌度,受溶液浓度、溶剂性质、温度等影响)有关[12]。
反思中学作业设计与命制,在巩固夯实双基的同时,应重视基于实证和对学科知识、概念本质的理解,避免知识理解窄化或错题的使用,造成片面学习或错误学习。有关导电能力变化曲线的作业如下:
在Ca(OH)2溶液中通入CO2气体,溶液的导电能力随CO2通入体积(V)的变化曲线是图2中的_______ 。(参考答案: B)
电迁移率[u∞×108/(m2·s-1·V-1)]: Ca2+ 6.16,OH- 20.52,通入CO2气体后,导电离子HCO-3的电迁移率(4.61)远低于OH-(20.52)的电迁移率,故作业设计图像模型有误。研究发现[13],向Ca(OH)2溶液中通入足量CO2气体并不能将CaCO3完全溶解,曲线不对称。正确的变化曲线模型如图3所示。
向Ba(OH)2溶液中逐滴滴加稀H2SO4,溶液的导电能力随H2SO4体积(V)的变化曲线图是_______。(参考答案如图4)
电迁移率[u∞×108/(m2·s-1·V-1)]: Ba2+ 6.59,OH- 20.52,滴加稀H2SO4后,SO2-4的电迁移率(8.27)略大于Ba2+的,而H+的电迁移率(36.30)大于OH-的。故作业设计图像模型有误。
2019版三套化学新教材中,除苏教版外,人教版[14]和鲁科版[15]均在《化学(必修第一册)》“离子反应”部分引入数字实验,探究向一定体积的Ba(OH)2溶液中逐滴加入稀硫酸,导电能力(或电导率)随时间的变化情况,分别如图5、图6所示。观察两幅图像,证实了上述两道作业设计图像模型有误。
数字实验的引入为许多实验提供了充足的证据,也纠正了许多错误的实验。对导电能力变化曲线图习题的错误纠正,进一步引导我们在教学中应重视知识的更新与学习,重视新的教育理念和教育教学手段的应用。为了进一步研究导电能力的变化情况,许多教师应用传感器做了大量的实验,其中,任雪明、吴文中团队做了“向NaOH溶液中逐滴滴加盐酸溶液的电导变化曲线”,如图7所示[16]。参照溶液中各微粒的电迁移率,结合曲线和数据发现,带相同电荷的离子,其导电能力并不与离子的式量成正比。
教师在教学中不仅要关注离子反应本质的探究,还要引导学生挖掘图中曲线所蕴含的深层次的内容——透过现象分析曲线不对称的具体原因,增强证据意识,践行“宏观辨识与微观探析”的核心素养的培养。
1.2 浓硫酸性质应用的学科本原问题提炼和实验现象的科学探究
浓硫酸的“三大特性”以及其有机化学反应常用催化剂等性质,备受试题命制的青睐。以“实验室制备乙酸乙酯,试剂的添加顺序”和“浓硫酸与锌的反应”为例,例举对浓硫酸性质应用的学科本原问题提炼和实验现象的科学探究。
1.2.1 实验室制备乙酸乙酯中试剂的添加顺序
中学教材中,实验室制备乙酸乙酯中试剂的添加顺序为“乙醇→浓硫酸→乙酸”,许多中学教师解释为,浓硫酸稀释放热,需考虑实验安全。故而认为,试剂的添加顺序还可以为“乙醇→乙酸→浓硫酸”或“乙酸→浓硫酸→乙醇”。那么,该实验试剂的添加顺序真如很多教师认为的基于“考虑浓硫酸的稀释放热”吗?
乙酸乙酯的制备中,起催化作用的微粒是H+。硫酸在水溶液中为强酸,但在乙酸溶液中为弱酸[Ka1(H2SO4)=6.3×10-9], c(H+)很低。因此,若向乙酸或乙酸和乙醇的混合溶液中滴加浓硫酸,将会抑制硫酸的电离,催化作用减弱。
弄清楚反应原理,精准提炼概念的学科本原,是解决问题的关键。如电解质的电离程度除了与电解质本身性质有关,还与溶剂的性质等有关。例举,H2SO4(一级电离)、HCl、 HNO3、 HClO4、 HI、 HBr这些强酸结构中与可电离氢原子结合的化学键不同,在不同极性溶剂中电离程度不同,表现的强度也不同。溶剂水(夺取质子的能力强)的拉平效应,使得它们在水中表现出相同的强度;甲醇、醋酸等(夺取质子的能力较弱)的区分效应,使它们显现出不同的强度: HClO4>HI>HBr>HCl>HNO3>H2SO4(一级电离)[17]。笔者曾命制如下试题,引导教师和学生在教学中加强对学科概念的本原性理解。
酸在溶剂中的电离实质是酸中的H+转移给溶剂分子,如HCl+H2OH3O++Cl-。已知H2SO4和HNO3在冰醋酸中的电离平衡常数Ka1(H2SO4)=6.3×10-9, Ka(HNO3)=4.2×10-10。下列说法正确的是_________ 。(参考答案: B)
A. 冰醋酸中H2SO4的电离方程式: H2SO4+2CH3COOHSO2-4+2CH3COOH+2
B. H2SO4的冰醋酸溶液中: c(CH3COOH+2)=c(HSO-4)+2c(SO2-4)+c(CH3COO-)
C. 浓度均为0.1mol·L-1的H2SO4或HNO3的冰醋酸溶液: pH(H2SO4)>pH(HNO3)