“DNA片段的扩增及电泳鉴定”实验探讨
作者: 匡彦蓓
【摘要】人教版高中生物学新教材中“DNA片段的扩增及电泳鉴定”探究实验相比旧教材有诸多处改动,在情境教学理论的指导下,越来越多的教师将单纯的实验课融合情境设计成为能够解决具体生活问题的情境课堂。聚合酶链式反应(PCR)实验技术广泛应用于生命科学研究的各个领域中,但该实验本身具有一定的操作难度。文章将结合相关文献资料和实践经验对“DNA片段的扩增及电泳鉴定”这一探究活动中的常见问题进行剖析并提供技术优化策略。
【关键词】生物教学;DNA片段;扩增;电泳鉴定;探讨
【中图分类号】G633.91【文献标志码】A【文章编号】1004—0463(2023)15—0102—06
人教版高中生物学新教材将“DNA片段的扩增及电泳鉴定”这一实验调整到选择性必修3·生物技术与工程中的第三章第二节“基因工程的基本操作程序”一节中,以培育转基因抗虫棉为具体情境,讲述基因工程的操作程序,让学生在情境中理解基因工程技术的应用。多聚酶链式反应(PCR)被用于目的基因的扩增,是生命科学研究中一项具有革命性的创举,也被誉为生物学研究技术发展的里程碑。PCR实验技术在生物学实验室中被广泛应用,是分子生物学研究的最主要实验技术之一,但是在具体操作过程中,不同目的基因的扩增需要不同的实验体系才能得到真实可靠的实验数据和结果。因此,PCR实验技术在操作上具有一定的难度,特别是对于高中教师来说,要想在一节实验课课堂上得到较好的PCR实验结果,需要实验教师预先多次进行实验,调整实验体系和实验条件,其中包括引物的设计和选择、Taq酶的选择、PCR循环程序的调整以及凝胶电泳条件的摸索等问题。新教材改革后,越来越多的教师也纷纷改进自己的教学方式,想通过更多具体的情境引导学生进行探究活动[1-3],激发学生的探究兴趣,并通过实验解决具体问题,培养学生的探究能力和创新精神。“DNA片段的扩增及电泳鉴定”这一实验在单纯的讲解过程中会显得比较抽象和枯燥,但这一探究活动非常适合与生物科学问题相结合,利用该实验技术解决相关问题,能够让学生动手参与并体验科研探究活动,在实验过程中培养学生的科学思维,让学生深刻理解基因工程相关概念并领略现代科学的技术魅力。鉴于PCR实验技术的操作具有一定难度,本文针对实验中相关细节问题进行探讨,希望能对教师的教学工作提供一些帮助和参考。
一、模板DNA的制备
1.模板DNA的种类。获取模板DNA的思路有两种,可以直接从细胞中提取基因组DNA,也可以先抽提细胞中的mRNA然后反转录成cDNA作为模板DNA。基因组DNA作为PCR模板通常用于目的基因的检测以及突变的比较,而cDNA作为PCR模板通常用于目的基因相对表达量的分析研究。
2.模板DNA的制备方法。直接提取细胞中的基因组DNA,需要分以下三种情况:在中学生物实验室,动物来源的DNA提取建议采用经典提取法,即苯酚/氯仿抽提法;植物来源的DNA建议采用CTAB法;微生物来源的DNA,如果需要提取质粒,可采用煮沸法、SDS裂解法、碱裂解法、Tri? ton-溶菌酶裂解法等提取。如果需要提取真菌DNA,破除细胞壁是关键,通常采取酶解法破壁或以液氮冷冻法破坏细胞壁[4]。张瑾直接使用酵母菌悬液代替DNA模板溶液,省去了DNA提取这一步,虽然实验结果可以看到条带,但是条带较宽且边界模糊,因此模板DNA的纯度会显著影响实验结果的呈现。若需要cDNA,为模板进行实验,需要先提取细胞中的mRNA,常用的mRNA提取方法有TRIZOL法和CTAB法,这两种方法对于动植物以及微生物均适用[5]。提取好的mRNA经过反转录后可得到cDNA,即可作为PCR实验的模板。
综上,依据实验设计及实验选材可选择相应的模板制备方法,但在中学实验室中,无论是提取基因组DNA还是提取细胞中的mRNA,最建议使用生物试剂公司相应的试剂盒完成DNA模板的制备,可以大大缩短制备时间并保证DNA模板的纯度。
二、引物序列的获取
引物是指人工合成的可以与模板DNA特异性结合,并引发新链合成的较短的DNA片段。在生物实验室中,引物序列的获取通常有两种方法:自行设计引物或者使用其他研究已使用过的引物。引物的设计有诸多原则,因为引物的长度、含氮碱基C+G的含量、回文序列的存在等因素均会影响目的基因特异性扩增的效率,设计不合理的引物会导致非特异性扩增甚至PCR扩增失败[7]。对于高中教师来说,自行设计引物难度较大,而且设计好的引物需要通过验证才能用于正式实验,因此设计引物这种方法并不适合在中学生物实验室使用。更加方便快捷的方法是根据所要研究的目的基因,通过数据库检索或者文献调研获取其他研究人员已经使用过的引物序列。常用的引物数据库有Primer Bank,可通过基因名称直接检索到相关引物序列。文献调研可以通过中国知网、National Center for Biotechnology Information(NCBI)等网站检索目的基因的相关研究,直接获取引物序列。
三、PCR的反应体系
1.反应体系的体积。新教材中所提供的PCR反应体系是50μL,实际上PCR实验的体系总体积从20μL到100μL都可以,而且20μL的反应体系在最后的琼脂糖凝胶电泳鉴定中也能有很好的呈现效果,因此,教师可根据个人的实验计划调整反应体系的总体积,只要注意各个组分的终浓度在合理范围内即可。由于PCR实验反应体系体积较小,各试剂用微量,中学生又是第一次使用微量移液器,所以教师应多强调加样的准确性。加样顺序遵循由多到少的原则,即先加体系中使用量最大的水,然后依次是扩增缓冲液、引物、模板等试剂。加样完毕后需要在瞬时离心机上进行离心,避免试剂挂壁对反应造成影响。
2.反应体系的组分调整。反应体系中引物的量对实验结果有显著影响。引物浓度太低会造成产物量过少,而引物浓度过高会造成引物二聚体和非特异性扩增产物的产生。引物在体系中的终浓度范围一般在0.1~0.5μmol/L[7],如果预实验结果不理想,可尝试调整引物浓度。
反应体系中使用的Taq酶种类较多,一般情况下建议中学生物实验室购买普通Taq酶即可。但是如果普通Taq酶扩增出的实验结果不理想,可尝试更换Taq酶解决问题。例如,琼脂糖凝胶电泳显示有杂带,可选择热启动Taq酶,这种酶具有更高的特异性和灵敏度;如果模板DNA是粗提取产物,或者提取的DNA模板纯度不够,甚至是酵母菌混悬液,建议使用具有高保真性的聚合酶。
反应体系中的模板用量也很重要,2007版的旧教材建议DNA模板用量是1 pg~1 mg,新教材中DNA模板用量修改为1 pg~1μg。实际上根据实验室经验,在PCR实验中,DNA模板在纯度较高的情况下,20μL的反应体系中1~200 ng的模板用量都能有较好的实验结果。相关研究表明,反应体系中模板浓度低于300μg/mL时,可通过PCR获得大量扩增产物;当模板浓度上升到300~800μg/mL时,PCR扩增产物的量明显减少;当模板浓度高于800μg/mL时,很难获得PCR产物。DNA模板的用量过高,会造成电泳条带拖尾,甚至会产生抑制PCR的作用,可能的原因是模板浓度较高会导致引物的相对浓度降低,退火和复性时大量模板自身相互结合导致引物不能有效与模板结合,从而抑制PCR反应[7]。因此,在DNA模板纯度较低的情况下可适当提高模板用量,在模板纯度较高的情况下使用较少的模板用量即可。
四、PCR的循环程序
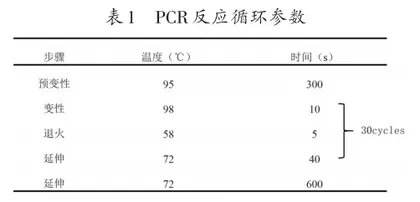
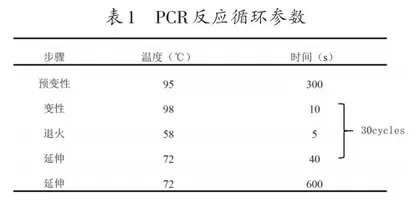
PCR的循环程序涉及预变性、变性、退火、延伸等多个步骤,表1的PCR反应循环参数是经过多次实践优化后的程序设计,对绝大多数常见基因有良好的扩增效果,与教材提供的程序相比,该程序显著缩短了反应时间。当然PCR反应程序并不是固定不变的,如果扩增效果不理想,生物学实验室通常会根据不同DNA模板的长度以及C+G含量等因素对PCR循环程序进行微调。在对PCR循环程序进行调整的过程中,最常调节的是退火温度。退火温度的设定要依据引物的长度、浓度以及碱基组成等因素。适宜的退火温度可以有效减少非特异性扩增的产生。一般情况下,较低的退火温度可以提高PCR反应的敏感性但降低其特异性,而较高的退火温度会提高 PCR反应的特异性但降低扩增效率。退火温度通常设置范围为45~55℃,适宜的退火温度是引物的Tm值再降低5℃[7]。在中学生物实验室中,若需要调整退火温度,建议教师设计退火温度梯度,PCR选取一个扩增效果最好的退火温度即可;如果采用的引物是其他研究人员使用过的引物,直接采用文献中的退火温度即可。
五、琼脂糖凝胶电泳及鉴定
1.琼脂糖凝胶浓度的选择。琼脂糖凝胶电泳是检测PCR产物最常见最便捷的方法,通过电泳可以鉴定出扩增产物的有无及大小。琼脂糖凝胶电泳的原理:在碱性的电泳缓冲液中,线状DNA双链带有净负电荷,在电场力的作用下, DNA可以穿过琼脂糖分子间的缝隙从负极向正极泳动,并且在凝胶中的迁移速率与DNA分子量大小成反比,即分子量越大的DNA分子迁移速率越慢。而一个固定碱基数目的线状DNA,在不同浓度的琼脂糖凝胶中的迁移速率不同。为了有效地将不同大小的DNA在电泳过程中分离开,需要选择合适浓度的琼脂糖凝胶,基本原则是DNA片段越小,选用的琼脂糖凝胶浓度越大。中学生物实验室可依据表2选择适合扩增片段的琼脂糖凝胶的浓度。
2.琼脂糖凝胶的配制。琼脂糖凝胶在配置过程中,需要在琼脂糖溶液冷却至60℃时加入核酸染料,市面上所售的常见核酸染料有:EB(溴化乙锭)、GoldView、GelGreen和SYBR Green等。对于中学实验室来说,几种核酸染料的灵敏度差异不大,都能满足相关实验需求。主要差异在于安全性和价格上,比较廉价的EB和GoldView生物毒性较大,而价格较高的GelGreen和SYBR Green毒性相对较低。无论是使用哪种核酸染料,在实验中教师一定要强调在制胶和手持胶的过程中是需要佩戴一次性PE手套防止核酸染料渗入皮肤,以保证学生的安全。琼脂糖凝胶配置的步骤也需要注意将温热的琼脂糖溶液迅速倒入模具,并插入大小合适的梳子,以形成凝胶孔,这样的操作顺序容易使制备的凝胶在上样孔处形成较多气泡,从而影响条带形状。根据生物实验室的实际操作经验以及PCR理论与技术的指导,应该是先在水平桌面上放置好制胶模具并架好梳子,待熔化好的琼脂糖溶液冷却至60℃时将其倒入模具,并用牙签排掉溶液中的气泡。
3.电泳的条件。琼脂糖凝胶电泳时,加样孔位于电泳槽负极(一般黑色为负极)一侧,电压设置是根据扩增片段的大小来调整,扩增片段分子量越大,可适当上调电压。例如,200~400bp的PCR产物使用50V电压,电泳时间20~40分钟。需要注意的是,电压越大,电泳速度越快,过快的电泳速度容易使条带产生变形,因此不能为了缩短电泳时间而施加过大的电压。电泳时间长短是通过观察载样缓冲液蓝色条带的位置来确定。
六、实验结果的分析方法
根据高中生物实验课程的相关实验设计,通常PCR凝胶电泳的结果分析可以分为两大类:定性分析和半定量分析。两种分析都需要进行凝胶电泳条带的观察和判读。实验中向琼脂糖凝胶中加入的核酸染料会与DNA分子结合,在紫外线的照射下可以观察到与染料结合DNA分子会发出荧光,可以在暗室中直接用肉眼观察实验结果或者使用专门的拍照成像系统来记录实验结果。由于DNA电泳的迁移距离和片段大小之间的关系是非线性的(如图1所示),因此无法直接通过距离来确定某个位置DNA片段的大小。对凝胶电泳条带的判读,通常情况下需要借助标记物marker,标记物marker与实验样品同时加入上样孔进行电泳,电泳结束后,添加了标记物marker的泳道会分离出已知片段大小的DNA条带。通过对照标记物marker的说明书,可以确定不同位置每个条带的大小。将样品扩增出的条带与标记物marker进行比较,可以确定样品中扩增出的片段大小,从而判读该条带是扩增出的目的条带还是杂带(如图2所示)。