基于“科工整合”的“速率和平衡”大单元复习教学
作者: 王换荣 陈进前
摘要: 工程思维是在“科学实践活动中凝练出科学思维”的基础上建立的一种可操作性的高阶思维。依据工程活动“设计与决策、研发、实施、实现”四个层次,以“利用工业废气中的CO2为碳源催化加氢合成甲醇”为例展开五步教学,基于“科工整合”实施“速率和平衡”大单元复习,引导学生站在“全过程”的视域高度形成“利用化学反应规律调控化学反应”的新认识,构建“设计化学反应解决化工问题”的一般思路。
关键词: 科工整合; CO2催化加氢; 大单元复习; 科学思维; 工程思维
文章编号: 10056629(2024)01005207
中图分类号: G633.8
文献标识码: B
实际生产和生活中,人们需要建立科学思维来分辨各种事物的相同和相异,辨析复杂体系中多因素之间的相互关联,并能剖析多因素形成的多维立体网络,最终实现不断的创新和创造[1]。科学思维重视科学探究的过程和方法,而工程实践过程中往往伴随着科学探究过程。
化学与生产生活紧密相联,化学教学中的科学思维与工程思维密不可分。《普通高中化学课程标准(2017年版2020年修订)》(以下简称“新课标”)规定的五大核心素养中的“变化观念与平衡思想”和“证据推理与模型认知”是从学科思维方式视角对化学科学思维的描述。而工程思维正是以某真实问题为驱动框架、具体情境为探究载体,让学生在任务的驱动下通过合作、交流等方式解决问题。可见,将化学学科知识运用于化工生产需要工程思维,在化学教学中有必要贯穿工程思维[2]。
1 思维的概述
1.1 思维及科学思维的概念界定
思维是在社会实践中产生的人类所特有的思想和精神活动,具体指在各种现象、各类概念的基础上进行分析和综合、判断和推理等认识活动的过程[3]。通常,工程思维、科学思维和艺术思维是三种不同的思维方式[4]。
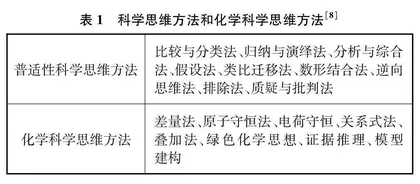
科学思维是指为正确而严谨地认识客观事物,人脑借助信息符号加工处理感性材料的思辨途径和认识方法。科学思维形成并作用于科学认识活动,是连接实践与理论的桥梁[5]。《义务教育化学课程标准(2022年版)》指出:“化学科学思维是从化学视角对客观现象独立思考、判断、质疑与批判,并提出创造性见解的能力;研究物质及其变化规律的思路与方法;建立宏观、微观、符号、图像四重表征的认识方式。[6]”具体的科学思维方法和化学科学思维方法见表1。化学科学自身独特的思维方法体系,可以破解学生学习过程中“繁、难、乱”等困扰[7]。
1.2 工程思维的内涵及特征
工程活动是实践活动,工程思维则是实践性思维。工程思维的目的是“建造技术人工物,即创造工程活动的产品”,非但包括实物,还包括各种“信息和服务产品”。工程思维的过程可看作“设计出一个恰当的实现工程目标的操作路径的过程”[9]。可见,工程思维具有逻辑性、灵活性、深刻性等思维的一般特征,也具有创新性、情境性、系统性等显著特点[10]。换言之,工程思维具备可行性和操作性。
2013年美国颁布的《新一代科学教育标准》,首次将科学与工程实践整合进了基础教育阶段,着力发展学生的创新思维。我国《义务教育科学课程标准(2022年版)》和化学、生物、技术等学科的普通高中课程标准(2017年版2020年修订)
也首次融进了工程技术,提出工程技术的核心是设计,目的是解决实际问题和制造产品。工程思维属于高阶思维,对提升学生的核心素养意义深远[11]。
化学教学中的工程思维异于工程领域中的工程思维[12],它是立足于科学思维的培养,将学习化学知识和技能的过程沉浸于相应的工业情境中,并能解释、解决真实境域中的问题[13],并不断修正学生运用统筹性思维权衡解决问题的思维方式。
2 主题及教学目标的确立
科学和工程相互交叉、关联。因此,“科工整合”是化学教学中工程思维培养的有效路径。设计一个化学反应用于实际化工生产时,必然遇到选择适宜反应条件的问题。新课标要
求教学中要创设化工生产路线的选择等真实情境,组织学生开展基于能量利用需求、综合优化反应条件及能量转化路径、装置等活动,形成合理利用能量的意识和思路,提升“科学探究与创新意识”和“科学态度与社会责任”的核心素养。基于上述分析,将研究主题确定为“基于科工整合的速率和平衡大单元复习教学——以催化加氢让二氧化碳变废为宝为例”。
预设以下教学目标:通过设计并选择“利用工业废气中CO2合成甲醇”的反应及对反应条件的综合优化,体会反应的焓变、熵变、速率和平衡相关知识的应用价值,形成从物质转化及反应的方向、快慢、限度等多个角度综合分析、解决工业问题的基本思路;树立绿色化学理念,认识到利用化学反应将无用物转化为有用物是解决环境问题的重要途径;知道开发低温下具有高活性和高选择性的催化剂对促进化工发展的重大意义。
3 教学实践过程
3.1 创设情境,运用工程思维确定探究任务
[教师介绍课题背景]当今世界面对的两大技术难题都围绕“燃料”展开,一是化石燃料趋于耗尽,二是CO2排放量超标。
[提出问题]你能以工程师的角色,运用化学反应原理,设法利用CO2来合成新的能源变废为宝,改变能源结构吗?观看“化石能源趋于耗尽”的视频,进行小组讨论。
3.2 搭建桥梁,运用工程思维分解任务
把全班同学分成8个小组,6人一组。确定从5个任务展开探索,师生共同规划确定研究方案。
3.2.1 任务1 设计化学反应——以CO2为碳源,选择氢源来合成甲醇
[信息支持]甲醇易传输,可以单独或者与汽油混合作为汽车燃料,将成为21世纪最有竞争力的清洁燃料之一。随着能源日渐减少,人们正在积极寻找新的碳源来合成甲醇。目前,最有希望开展大规模应用的是CO2加氢生成甲醇的反应。
[过渡]基于此,确定本节课的主题是“利用工业废气中的CO2来合成甲醇”。
[问题]你能以CO2为碳源,从化合价的角度选择氢源合成甲醇,并写出方程式吗?
[学生]CO2中的碳从+4价降低到甲醇中的-2价,选择常用的含氢还原剂H2,方程式是CO2+3H2CH3OH+H2O。
[问题]你能从“原料来源广泛、廉价易得”这个角度来选择氢源吗?
[学生]水!方程式是2CO2+4H2O2CH3OH+3O2。
[总结]我们可以遵循元素观、守恒观和价态观来设计化学反应。
3.2.2 任务2 选择化学反应——依据
ΔG=ΔH-TΔS<0,判断反应的自发性
[过渡]我们设计的这两个反应不一定可行。
[信息支持]给出298K、 100kPa条件下焓变和熵变的数据,假设反应ΔH、 ΔS不随温度的改变而变化。
Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)
ΔH1=-48.97kJ·mol-1
ΔS1=-177.16J·mol-1·K-1
Ⅱ:CO2(g)+2H2O(g)CH3OH(g)+3/2O2(g)
ΔH2=+676.48kJ·mol-1
ΔS2=-43.87J·mol-1·K-1
[问题]如何分析这两个反应的可行性?
[学生]根据吉布斯自由能变ΔG=ΔH-TΔS<0,反应能自发。反应Ⅰ的ΔH<0, ΔS<0,低温能自发。反应Ⅱ的ΔH>0, ΔS<0,在任何温度下均不自发。
[总结]ΔG<0只能用于判断等温、等压及只做体积功条件下,反应正向自发进行的趋势,但反应能否实际发生还涉及速率问题。
3.2.3 任务3 微观分析化学反应——结合能垒图,解释反应过程
[信息支持]给出恒容密闭容器中,加入CO2、 H2和催化剂PST、 500℃时反应历程和能垒图1。TS表示过渡态,*表示吸附在催化剂表面的物种。
[过渡]已知TS为过渡态,图1中共3个过渡态,第3个过渡态使用了催化剂。
[问题]你能结合反应历程分析使用催化剂PST时的两个基元反应吗?
[学生]第1个是CO2(g)+H2(g)CO(g)+H2O(g),第2个是CO(g)+2H2(g)CH3OH(g)。
[问题]这两个基元反应中,哪个是决速步骤?
[学生]慢反应是决速步骤,根据活化能大的为慢反应,图1中显示第1个基元反应是慢反应,第2个则是快反应。
[问题]你能画出反应历程和能量变化图吗?
[学生]第1个基元反应吸热,第2个放热,且第1个的活化能大于第2个。
[过渡]投影并指出图2中的细节,强调要标出具体的反应物和生成物及各物质的状态和计量数。
[问题]结合反应历程分析,科研人员在调试反应条件的过程中,监测到了除甲醇之外的什么物质,为什么?
[学生]CO。说明在发生主反应的过程中存在副反应:CO2(g)+H2(g)CO(g)+H2O(g)。
[问题]在生产中,要尽可能地促进主反应而抑制副反应的发生,可以采取什么措施?
[学生]选择合适的催化剂,提高主产物甲醇的选择性。
[问题]你能结合历程图,分析此温度下催化剂PST如何较好地提高甲醇的选择性吗?
[学生]生成过渡态1和2的主、副反应历程都相同,不同的是生成过渡态3的这一步。如果没有催化剂,CO2和H2就会发生副反应。催化剂的存在使得活化能降低生成甲醇。
[教师补充]反应历程中,决定催化剂选择性较高的步骤是生成过渡态3的这一步。
[问题]你能书写生成过渡态3的方程式吗?
[学生]CO*(g)+H2O(g)+2H2(g)CO(g)+H2O(g)+2H2(g)或CO*(g)CO(g)。
3.2.4 任务4 选择反应条件——依据实验参数,多角度考虑因素。
[过渡]微观上副反应的发生导致了甲醇的选择性较低。工业中主要依据实验数据,从催化剂的角度来选择反应条件,提高甲醇的选择性。
[信息支持]给出温度553K、总压4MPa下,n(H2)∶n(CO2)=3∶1时,不同催化剂组成对甲醇产率、选择性及副产物CO选择性的影响,见表2。
[问题]你认为工业生产中应选择第几组催化剂?依据是什么?
[学生]若从甲醇纯度的角度来看,选择第3组催化剂。若从甲醇产率的角度来看,选择第4组催化剂。即3、 4组均可,只是催化剂组分的比例不同。
[过渡]我们还能从浓度的角度来选择反应条件。
[信息支持]给出总压2MPa、温度553K下,催化剂为CuOZnOAl2O3时,随着H2和CO2物质的量之比增大,得到CO2的转化率α和甲醇产率的值,见表3。
[问题]总压恒定,增大H2与CO2的投料比,二者的浓度如何变化?CO2的转化率和CH3OH的产率如何变化?
[学生]压强不变,随着H2比例的增多,H2的浓度增大,CO2的浓度减小,CO2的转化率增大,甲醇的产率也增大。
[问题]H2与CO2选择怎样的比例比较好?
[学生]3∶1。因为3∶1时CO2的转化率比较大,甲醇的产率也比较大,且继续增大H2的比例,成本增大,但CO2的转化率和甲醇的产率增大幅度均不大。
[过渡]好,选择3∶1。现将H2与CO2比例不同对CO2转化率和甲醇产率的影响转化成折线图3。
[问题]选择CuO/ZnO/Al2O3这组催化剂时,不论H2和CO2的比例多大,副产物CO的产率终归在甲醇之上,为什么?