基于CER理论提高学科解释能力的教学实践
作者: 姚明站 杨砚宁
摘要: 借助CER理论模型,以废水中氨氮去除为真实情境,通过创设“情境问题”搭建脚手架,指导学生能够获取和处理信息以及分析推理获得与论断匹配的证据,形成“证据—推理—论断”的化学学科解释表达范式,提高学生的学科解释能力。
关键词: CER理论模型; 情境问题; 学科解释; 证据推理
文章编号: 1005-6629(2024)02-0034-07
中图分类号: G633.8
文献标识码: B
1 问题的提出
“化学学科解释”作为“科学解释”的一个学科分支,其内涵为解释者基于自身化学学科理解水平,采用化学学科特有的知识、理论、认知方式,通过外显的行为对现象发生的原因或过程用恰当的表征方式予以阐述[1]。化学学科解释类问题是以真实情境和实际问题为测试载体,设计出主题性、开放性、探究性的评价任务,是近几年高考化学试题的难点热点题型。该类问题具有信息处理复杂、信息呈现隐蔽、语言表达严谨、方法运用灵活、思维活动高阶和育人价值导向等特点[2]。
面对学科解释类问题,学生表现出一些共同的困难。通过访谈、问卷等形式的调查,分析造成困难的主要因素为:
(1) 学科理解欠缺。解释能力不仅仅是一种语言行为,而是与头脑中深层次的学科理解息息相关。在建构解释时,证据选择和推理过程中的困难多源自对学科内容的理解不全面、不深刻。
(2) 解题策略欠缺。在解决复杂问题情境的学科解释类问题时,仅具备基础学科知识还远不够,在陌生情境下,学生往往对情境信息的获取和处理能力不足,不理解什么是证据,不知道如何匹配恰当、充分的证据,不了解题目考查所指向的知识与能力,不清楚从何入手解题。
(3) 表述方法欠缺。在提取有效证据进行推理时,语言表述缺乏应有的逻辑性,一些解释中虽出现了某些证据和论断,但没能通过推理将两者相连[3],论断占了较大篇幅但只伴随着零星的理由。
如何有效突破学生在学科解释方面的困难,已成为高中化学教学的重要课题,科学解释能力的培养与提高亟待有针对性的教学干预和指导。
2 基于情境问题的CER理论模型
CER理论模型是对英国哲学家图尔敏(S.Toulmin)的论证模型的简化,将科学解释解构为三个要素:论断(Claim)、证据(Evidence)和推理(Reasoning)[4]。该模型旨在让学生像科学家一样,依据已有知识或相关资料,通过挑选和收集证据,在科学原理的支持下进行推理(证实或证伪),呈现证据支持论断的逻辑,形成对科学现象或问题的论断。《普通高中化学课程标准(2017年版2020年修订)》中明确指出,“情境”和“知识”同时服务于“问题”的提出与解决。在新课标新高考背景下,以真实问题情境为载体,以学科观念为统领,以化学学科知识为分析问题的视角,以发展学生思维的创新性、逻辑性、建模化为指向,以“情境+问题+思维”为主线的化学课堂教学范式备受青睐。
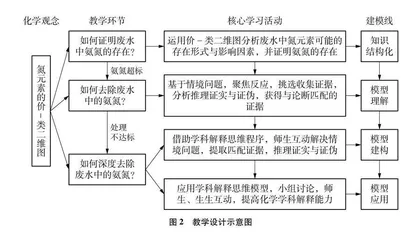
本文尝试借助CER哲学模型,以废水中氨氮的去除为问题情境,通过创设“情境问题”搭建脚手架,指导学生如何获取和处理信息,分析推理获得与论断匹配的证据,建构化学学科解释思维模型,引导学生把握学科解释的思维路径,形成“证据—推理—论断”的化学学科解释表达范式,以期解决学生在学科解释中遇到的困难,提高学生的学科解释能力(思维模型见图1)。
3 基于CER理论模型的教学案例
3.1 情境载体
选择合适的高考或重要的模拟考试题,将其设计成为教学情境,可以避免复习中探究问题角度偏、难度大、不严谨等弊端。本课例选择了2021年江苏适应考I第14题,以废水中氨氮的去除为情境,涉及沉淀法和氧化法去除氨氮的离子方程式书写以及相关的化学学科解释问题。
选择该情境载体的主要原因是:(1)贴近生活实际。废水中氨氮超标导致水体富营养化,情境素材贴近实际生活,是有价值的学习主题。(2)涉及较多的核心知识。如氮及其化合物的性质、氧化还原反应、化学反应速率与平衡、物质结构与性质等知识内容,为跨模块知识融合提供了平台,有利于促进知识的结构化。(3)蕴含丰富的思想观念。从学生视角看,有利于价-类二维视角理解物质转化、速率与平衡、控制变量等重要学科观念的形成,有利于促进认知模型化;从教师视角看,可以进行单元教学、项目式学习、“教-学-评”一体化教学等实践。
本节课的教学目标为:(1)以废水中氨氮的去除为问题情境,能从物质类别和元素价态的角度认识含氮物质之间的转化。(2)从“价-类”二维视角寻找废水中氨氮去除的方法,学会运用化学知识解决实际问题,促进化学学科理解。(3)体会化学学科的价值与魅力,增强社会责任意识。
教学重点为:建构化学学科解释思维模型,形成“证据—推理—论断”的化学学科解释表达范式。
3.2 教学过程
根据教学目标,通过情境问题,基于CER模型引导学生建构学科解释思维模型。本节课可分为三个环节:第一环节,如何证明废水中氨氮的存在。运用氮元素的价-类二维图,分析推理水体中氮元素的存在形式,并通过实验进行定性和半定量检测;第二环节,如何去除废水中的氨氮。运用氮元素的价-类二维图,通过CER理论模型,初步认识学科解释思维程序;第三环节,如何深度去除氨氮。通过师生互动外显思维,建构并应用学科解释模型解决学科问题。教学设计示意图如图2所示。
3.2.1 如何证明废水中氨氮的存在
[情境1]2007年太湖爆发了严重的蓝藻污染,太湖水污染问题引起了广泛关注。从化学学科的视角分析,“蓝藻”事件是什么元素给我们“颜色”看呢?
[学生分析解释]N、 P元素超标所致。
[情境问题1.1]结合氮元素的价-类二维图(图3)分析水体中氮元素可能的存在形态。
[学生]可能有NH3、 NH+4形式以及NO-2或NO-3。
[教师]在水溶液中,氨氮的存在形式主要由什么因素决定?
[学生]主要由水溶液的酸碱性决定,主要存在形式是NH3或NH+4。
[资料卡1]氨氮随pH变化的分布系数图,如图4所示。
[情境问题1.2]设计实验证明废水中是否存在氨氮污染?
[实验方案]取样,加浓氢氧化钠溶液并加热,若能产生使湿润的红色石蕊试纸变蓝的气体,则说明存在NH+4。
[学生汇报]不同浓度的氨氮废水中,有的检测出,有的没有检测出NH+4。
[教师]给同学们提供的是四种不同水样,分别是皮革厂氨氮废水、生活污水、小区旁河水和阳澄湖水。而该方法适用于浓度较高的氨氮废水的检测,氨氮浓度较低时往往无法通过该方法检测,故有的水样没有检测出NH+4。
[过渡]检测部门通常利用检测仪直接准确测定氨氮的含量。
[资料卡2]氨氮的定量测定方法通常有:纳氏比色法、水杨酸-次氯酸盐比色法、滴定法、氨气敏电极法等。
污水中氨氮检测时,常使用氨氮检测试纸(纳氏比色法)初步检测氨氮的含量。此方法具有操作简便、灵敏等特点。其方法原理为:以氨或铵离子等形式存在的氨氮与纳氏试剂反应生成淡红棕色络合物(该络合物的色度与氨氮含量成正比),并将之与标准比色卡进行对比。
[学生实验]用氨氮试纸检测上述四种水样中氨氮的含量,与氨氮排放标准对照分析是否超标。
操作步骤:取出试纸,迅速盖上盖子。
(1) 试纸反应区部分浸入待测水样中2秒,取出甩掉多余的水样。
(2) 在反应端加1滴激活剂,15秒后甩出多余的水珠。
(3) 放置60秒后与比色卡对比,颜色接近的色块即为被测样品的浓度值(见表1)。
[资料卡3]城镇污水处理厂水污染物排放标准(2003年7月1日执行)见表2。
[小结]阳澄湖水、小区旁河水均是达标的,生活污水氨氮超标,皮革厂废水中氨氮严重超标。
设计意图:聚焦问题情境,运用氮元素的价-类二维图,引导学生调用已有知识,了解含氮废水中氮元素的存在形式与影响存在形式的因素,并通过定性及半定量实验证明废水中氨氮的存在。
3.2.2 如何去除废水中的氨氮
[过渡]请结合氮元素的价-类二维图,设计氨氮去除的可行方案?
[追问]如何理解氨氮的去除?
[学生1]将氨氮从废水中转化成气体或沉淀而除去。
[学生2]加氢氧化钠后加热将氨氮转化为NH3除去——吹脱法。
[学生3]加氧化剂将氨氮氧化为N2除去——氧化法。
……
[教师]从物质状态角度分析,可将NH+4转化为气体(NH3或N2)除去,为什么没有借助沉淀法呢?
[学生]一般铵盐均易溶,不能转化为沉淀。
[教师实验]模拟氨氮废水与Fe2(SO4)3溶液混合,有黄色沉淀生成。
[资料卡4]黄铵铁矾沉淀:NH4Fe3(SO4)2(OH)6;磷酸铵镁(MgNH4PO4·6H2O)俗称鸟粪石,简称MAP,它的养分释放速率比其他可溶肥慢,可作缓释肥。
[情境2]皮革厂的废水中含有一定量的氨氮(以NH3、 NH+4形式存在),可向酸性废水中加入适量Fe2(SO4)3溶液,废水中的氨氮转化为NH4Fe3(SO4)2(OH)6沉淀而除去。
[情境问题2.1]写出沉淀法去除氨氮反应的离子方程式,该反应的本质是什么?
[学生分析解释]由题给信息可知,废水中的氨氮转化为NH4Fe3(SO4)2(OH)6沉淀,化合价没有发生变化且溶液呈酸性,故该反应的离子方程式为NH+4+3Fe3++2SO2-4+6H2ONH4Fe3(SO4)2(OH)6↓+6H+。由上述反应可知,生成沉淀是由于NH+4或Fe3+的水解所致。
[情境问题2.2]从上述反应分析,如何提高沉淀法去除氨氮的去除率?
[学生]增大Fe2(SO4)3溶液浓度、降低氢离子浓度、升高温度、充分搅拌等。
[情境问题2.3]沉淀法去除氨氮时,随pH的变化氨氮去除率如图5所示,氨氮去除率随pH升高先升高后降低,可能的原因是什么?
[证据推理]与氨氮沉淀反应有关的微粒有NH+4、 Fe3+、 SO2-4、 H+,其中c(SO2-4)不受pH影响。随pH增大,c(H+)减小,促进NH+4或Fe3+的水解,有利于氨氮的去除。当1.3<pH<1.8时,随pH增大氨氮去除率不升反降,可能的影响因素只剩下pH对NH+4和Fe3+的影响。由氨氮分布系数图可知,氨氮在这个pH范围内基本全部以NH+4形式存在,只能是Fe3+的影响。Fe3+是极易水解的,pH增大促进Fe3+水解生成Fe(OH)3沉淀,Fe3+浓度减小,导致氨氮去除率降低。但下降幅度并不是很大,应为部分Fe3+水解生成Fe(OH)3。
[学科解释]随pH增大,c(H+)减小,促进NH+4或Fe3+的水解,有利于氨氮的去除。当pH>1.3时,随pH增大部分Fe3+水解生成Fe(OH)3,溶液中c(Fe3+)减小,氨氮去除率降低。
[教师]沉淀法去除废水中的氨氮,能否达到排放标准呢?
[资料卡5]查找文献发现,利用硫酸铁生成黄铵铁矾沉淀去除氨氮,当氨氮浓度为2800mg/L时其去除率为81%,残留氨氮浓度为532mg/L[5];利用MgCl2·6H2O和Na2HPO4·12H2O生成MgNH4PO4·6H2O沉淀去除氨氮,当氨氮浓度为1305mg/L时,其pH为9.0,反应时间为25min,按n(N)∶n(Mg)∶n(P)=1.5∶1∶1.5配比投料,其去除率高达98.10%,氨氮浓度降低到28.54mg/L[6]。