基于科学推理与论证的初中化学教学实践
作者: 徐立堂 张贤金 郑婷婷
摘要: 以人教版“酸和碱的中和反应”为例,从“依据已有事实,初步论证酸与碱的反应→利用建构模型,论证盐酸与氢氧化钠的反应→辨识微粒变化,推理酸与碱的反应”三个环节具体阐述如何引导学生从素材收集、实验事实、宏观微观等视角对酸碱中和反应进行推理论证。围绕酸和碱之间能否发生反应进行分析,发展学生的学科思维,通过氢氧化钠与稀盐酸反应的个例论证,推理酸和碱之间发生反应的普遍规律,帮助学生建构化学观念,培育学生的核心素养。
关键词: 初中化学; 科学论证; 证据推理; 模型建构; 教学案例
文章编号: 1005-6629(2024)02-0053-05
中图分类号: G633.8
文献标识码: B
推理是以已有经验或已知素材为前提,通过大脑对信息的提取、加工处理、转化为对未知的判断或决策的一种思维[1]。科学推理的前身是皮亚杰提出的形式推理,当儿童认知发展到一定程度时才具有的思维,是有依据、有规则、高层次的推理,属于高阶思维范畴,较多的研究中将科学推理简称为推理[2]。论证是像科学家们一样基于已有知识、事实证据通过逻辑思考与不同观点或证据进行辩论反驳最终得到结论的过程[3]。《义务教育化学课程标准(2022年版)》强调要培养学生的科学思维,培养学生的证据推理能力是培养学生科学思维的重要内容[4]。本文以人教版九年级《化学(下册)》“酸和碱的中和反应”(第一课时)为例,具体阐述科学推理与论证在教学过程中的渗透与培育。
1 教学主题内容与教学现状分析
本课例选自人教版九年级《化学(下册)》第十单元课题2“酸和碱的中和反应”(第一课时)新授课内容,本课以探究酸和碱的反应为重点内容,要求学生能从物质类别角度完善酸类、碱类物质的性质,能从微观角度解释酸与碱反应的实质,能对生产生活中酸碱中和反应的应用进行解释。难点在于学生对酸碱反应的实验方案设计原理理解不清,缺乏证据收集与推理过程意识[5]。
通过查阅该课例相关文献,发现目前设计较好的课例主要有:(1)从调整课堂结构视角设计,先呈现酸和碱的微观粒子构成,再分析酸碱反应的微粒变化,通过问题链启发学生认识酸碱发生中和反应[6]。(2)从科学探究视角设计,对比多种酸与碱之间的反应,利用固体草酸与固体氢氧化钠反应生成水,或借助遇水变色硅胶验证水的生成,证明酸与碱之间发生了中和反应[7]。(3)从手持技术视角设计利用传感器测定酸与碱反应溶液中pH、温度、电导率的变化,证明酸与碱之间发生了中和反应等[8]。目前还鲜有从科学推理与论证的视角对该主题内容进行教学设计的报道,笔者认为从该视角出发进行设计,有助于酸碱中和反应知识生活化、判断化学反应方法化、证据推理过程精细化,有利于培养和发展学生的科学思维。
2 教学思路
借鉴已有的科学推理与论证相关课例,创设酸碱中和反应的科学推理与论证课堂,和以往的教学课堂相比更注重学生证据的收集与思辨推理过程。教学设计思路为:提出问题→提供事实证据→思辨推理→实验论证→得出结论;整个教学过程包含三个主要环节:依据已有事实,初步论证酸与碱的反应;利用建构模型,论证HCl与NaOH的反应;辨识微粒变化,推理酸与碱的反应。教学过程中,基于原有知识、事实证据和实验证据的基础上进行推理与论证,通过思辨推理达到实验方案或思路方法的优化,进一步利用实验论证得到相关结论,促进学生的科学思维在科学推理与思辨论证过程中得到发展。
3 教学目标
(1) 根据已有知识体系和实验事实进行推理论证,建构无明显现象实验的验证模型,形成反应物消耗或生成物生成的视角判断化学反应的思路与方法。
(2) 设计实验方案验证稀盐酸与氢氧化钠的反应,通过各组收集的信息展开讨论、辩析与反驳,对设计方案进行可行性论证,选取最优方案来验证反应的发生,在推理论证中形成思维碰撞,发展科学思维。
(3) 通过传感器技术测定氢氧化钠与稀盐酸的反应过程,进一步推理论证反应的实质,得出酸与碱发生中和反应,形成从单一物质到一类物质的研究思路。
(4) 认识生活中某些酸性物质和碱性物质的用途,体会中和反应在生活中的广泛应用,形成合理利用资源的意识。
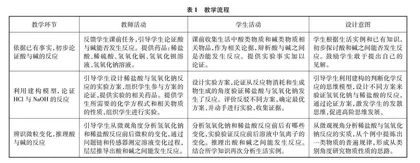
4 教学流程
教学流程见表1。
5 教学实录
5.1 依据已有事实,初步论证酸与碱的反应
本环节主要引导学生根据事先收集到的生活实例对酸与碱能否反应进行论证。
[教师]请同学们结合所学知识和生活经验论证酸和碱之间能否发生反应。
[学生提供事实1]我认为酸类物质和碱类物质能反应,胃酸过多时我们会吃些含有碱性物质的药物,如胃舒平,其主要成分为Al(OH)3,可以缓解我们胃酸过多,所以酸与碱之间能够发生反应。
[学生提供事实2]我们山上的土大部分都是黄色的酸性土壤,每次我家在播种植物之前,都会购买一些熟石灰粉撒在酸性的土壤里,减小土壤酸度,使植物生长得更好,所以酸与碱之间能够发生反应。
[学生提供事实3]我认为应该是部分的酸和碱之间能发生反应,有一些就不能反应,如氢氧化钠和稀盐酸加在一起无反应现象,说明有的酸和碱之间是不会反应的。
[学生反驳思辨]没有明显现象并不代表不会反应,我们之前所学的二氧化碳和水的反应就是没有明显的现象。可以在实验室里将酸和碱加在一起看看是否能够发生反应来进行验证。
[分组实验]将稀盐酸或稀硫酸分别加入装有氢氧化铜(固体)、氢氧化钡溶液、氢氧化钠溶液的试管中,观察现象。
[实验证据]把稀盐酸或稀硫酸滴入氢氧化铜中观察到固体溶解了,两者能发生反应;把稀硫酸滴入氢氧化钡溶液中观察到白色沉淀,说明二者能发生反应;稀盐酸分别加入氢氧化钠溶液和氢氧化钡溶液均观察不到明显现象,不知道二者是否能发生反应。
[教师]以氢氧化钠溶液和稀盐酸混合为例,如何判断二者之间是否发生反应?结合之前学过的知识如何建构判断化学反应的思维模型?
[学生模型建构]判断是否发生化学反应:若反应有沉淀生成、气体产生或颜色变化等明显现象可以通过直接观察来进行判断,若无明显现象可以从验证反应物的消耗或生成物的生成角度来进行判断。之前在证明二氧化碳能否与水反应是借用紫色石蕊来判断是否有新物质生成,因此可以借助一些物质使反应出现明显现象,来判断反应物是否消耗或生成物是否生成。建构判断化学反应的思维模型如图1所示。
[模型迁移]结合模型要验证氢氧化钠和稀盐酸是否发生反应,可以验证反应物稀盐酸和氢氧化钠有没有被消耗或者有没有新的物质生成。
5.2 利用建构模型,论证HCl与NaOH的反应
[模型应用一]从反应物消耗角度设计实验方案,验证稀盐酸和氢氧化钠能否发生反应。
[学生方案1]可以借助紫色石蕊溶液来判断稀盐酸和氢氧化钠之间是否能够发生反应,先往试管中加入稀盐酸,滴加几滴紫色石蕊溶液,再加入氢氧化钠溶液,如果能反应则可以观察到溶液先变红色后变紫色。
[学生反驳思辨]方案1中红、紫、蓝三者间的颜色变化不是很好判断,并且根据色彩叠加原理,红色和蓝色叠加所呈现出的颜色为紫色,那溶液变为紫色是叠加的结果还是二者确实发生反应了呢?
[学生方案2]可以借助酚酞溶液,先往试管中加入稀盐酸,滴加几滴酚酞,再加入氢氧化钠溶液,如果溶液由无色变为红色就能说明二者之间发生反应了。
[学生反驳思辨]酚酞遇碱变红,无色叠加红色所呈现的颜色也是红色的,溶液由无色变红色可能是颜色叠加结果。可以先往试管中加入氢氧化钠溶液,滴加几滴酚酞,再加入稀盐酸溶液,如果溶液由红色变为无色则说明二者发生了反应。
[学生分组实验验证]先往试管中加入氢氧化钠溶液,滴加几滴酚酞,再逐滴加入稀盐酸溶液,观察实验现象与预设相同,证明氢氧化钠溶液与稀盐酸发生了化学反应。
[模型应用二]刚才从反应物消耗的角度,验证了稀盐酸与氢氧化钠溶液发生了反应,那能否从生成物生成的角度来验证二者之间发生了反应呢?提供相关资料卡,如图2所示,请同学们设计实验方案进行论证。
[学生方案1]将氯化氢气体通入到氢氧化钠固体中,如果产生小水珠则说明,二者反应生成了水。
[学生思辨推理1]氯化氢气体有毒,暴露在空气中的氢氧化钠易潮解,且易与空气中二氧化碳发生反应,操作不易。我认为证明生成NaCl的更方便操作,可以直接在反应后的溶液中加入硝酸银溶液,若能产生白色沉淀,说明生成物中含有氯化钠。
[学生思辨推理2]我认为上述方法不妥,如果HCl与NaOH不发生反应,或反应后溶液中稀盐酸过量,溶液中均存在Cl-,加入硝酸银溶液也能生成白色沉淀。
[学生思辨推理3]NaCl溶液蒸发可以得到氯化钠晶体,我设想的是将HCl与NaOH反应后的溶液倒入蒸发皿中进行蒸发,如果得到氯化钠晶体,那么就证明HCl与NaOH发生反应,生成新物质氯化钠。
[学生思辨推理4]上述做法虽有一定道理,但是直接蒸发得到的晶体就一定是氯化钠晶体吗?也有可能是反应物过量的晶体。浓盐酸具有挥发性,若是稀盐酸过量则不影响,但如果是氢氧化钠过量,在蒸发过程就会出现氢氧化钠晶体,进而影响实验结果。我认为应该先测定氢氧化钠是否过量的问题。
[学生思辨推理5]不需要将反应后的全部液体进行蒸发,可以取少量液体蒸发,能否少到几滴的量,这样蒸发快且节约资源。
[最终方案]先取适量HCl与NaOH反应后的溶液,利用酚酞溶液检测溶液中没有氢氧化钠存在的情况下,再用玻璃棒蘸取HCl与NaOH反应后的溶液,放在酒精灯火焰上加热,若出现白色晶体则说明HCl与NaOH发生反应生成了氯化钠[9]。
学生分组实验观察到玻璃棒上确实出现了白色晶体,确认HCl与NaOH发生了反应。
5.3 辨识微粒变化,推理酸与碱的反应
[教师]我们刚才已经从宏观角度证明了HCl与NaOH之间能够发生反应,能否从微观角度来分析HCl与NaOH在反应前后溶液中微观粒子有什么变化呢?
[学生提供事实]从微观上分析,盐酸在溶液中会电离出H+与Cl-,NaOH在溶液中会电离出Na+和OH-,反应后溶液中生成NaCl和H2O,NaCl在溶液中会电离出Na+和Cl-,水主要以水分子的形式存在。
[学生思辨推理1]反应前后Na+和Cl-没有发生变化,变化的微观粒子有H+和OH-,所以我推测反应过程应该是H+和OH-发生反应生成H2O。
[学生思辨推理2]溶液中本来就存在水,如何能够证明体系中的H+和OH-生成了水?
[学生思辨推理3]有没有仪器能够测定溶液中氢离子浓度和氢氧根离子浓度发生变化,如果能测定出这两种离子浓度发生了变化,则说明H+和OH-发生了反应。
[教师]介绍测定溶液氢离子浓度的仪器pH传感器,介绍pH表示的意义,提供传感器测定溶液中离子的变化过程。
[学生实验]学生操作利用pH传感器测定氢氧化钠与稀盐酸反应前后溶液中pH变化过程如图3所示。得出结论:往氢氧化钠溶液中加入稀盐酸溶液pH不断减小,OH-浓度不断减小;往稀盐酸溶液中加入氢氧化钠溶液pH不断增大,H+浓度不断减小。说明H+和OH-发生了反应。
[教师]从实验中同学们是否能够得知酸和碱之间能发生反应呢?
[学生论证推理]酸类物质都含有H+,碱类物质都含有OH-,当H+遇到OH-时二者可以发生反应生成水,说明酸和碱之间能够发生反应。
[教师]前面分组实验中,几个无明显现象的实验:稀硫酸与氢氧化钠、稀盐酸与氢氧化钡,它们之间能否发生反应?若能请写出相应的化学方程式。