基于IFR思维方法发展学生创新思维的教学实践
作者: 施志斌 黄丹青
摘 要: 发展创新意识的关键是创新思维的形成与发展以及掌握思维创新的方法。以“化学电源”教学为例,通过完成四个微项目活动,运用IFR思维方法,分析化学电源史上的重要技术创新,帮助学生认识化学电源的创立与变迁,培养与发展学生的创新思维能力。
关键词: 高中化学; 创新思维; IFR思维方法; 思维训练; 化学电源
文章编号: 10056629(2024)08004906
中图分类号: G633.8
文献标识码: B
二十大报告提出,到2035年我国将实现“高水平科技自立自强,进入创新型国家前列”的奋斗目标。创新不仅是国家高质量发展的驱动力,也是工业4.0时代背景下的个人必备技能[1,2]。《普通高中化学课程标准(2017年版2020年修订)》(以下简称“新课标”)将“科学探究与创新意识”列为化学学科核心素养之一,倡导教师在教学活动中通过探究活动开展创新教育[3]。创新意识是科学实践活动中主动性的、创造性解决问题的思维能力[4,5]。因此,开展创新教育的关键是将创新思维训练融入情境化的问题解决过程,以促进创新思维的形成与发展。
创造性心理学认为,提高创新思维能力需要运用多种不同的训练模式(如“创造性问题解决过程”“提出问题解决训练”等),在训练中还需要运用适当的思维方法(如“头脑风暴法”“举偶法”等)[6]。适当的思维方法可以激发学生的创新动力,使他们在思维训练过程中维持较高的思考专注度,保证思考过程的高效性。IFR思维方法(Ideal Final Result)是一种启发式创新思维方法,通过明确创新方向,利用问题链展开逆向分析,最终形成创新性解决方案[7]。在中学化学课堂开展创新思维训练,可借助IFR思维方法逆向剖析经典化工技术的发明过程,有序分析与解决问题,提高学生的创新思维能力。
基于此,本研究以苏教版高中化学必修第二册的“化学电源”为例,以自制化学电源过程遇到的技术问题为情境,通过完成四个微项目活动,运用IFR思维方法,分析化学电源史上的重要技术创新,帮助学生认识化学电源的创立与变迁,开展创新思维训练。
1 IFR思维方法概述
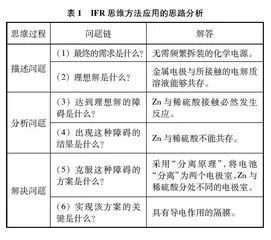
IFR思维方法是苏联发明家Altshuller于20世纪中期提出的TRIZ(拉丁文:Teoriya Resheniya Izobreatatelskikh Zadatch)理论的核心思维方法之一。由于IFR思维方法具有思考方向明确、解决问题高效等优点,被广泛应用于高校的创新设计课程、企业的产品研发设计等。其思维过程包含描述问题、分析问题和解决问题等三个阶段。以伏打电堆的改进为例,IFR思维方法的具体路径分析见表1。
表1 IFR思维方法应用的思路分析
思维过程问题链解答
描述问题
(1) 最终的需求是什么?无需频繁拆装的化学电源。
(2) 理想解是什么?金属电极与所接触的电解质溶液能够共存。
分析问题
(3) 达到理想解的障碍是什么?Zn与稀硫酸接触必然发生反应。
(4) 出现这种障碍的结果是什么?Zn与稀硫酸不能共存。
解决问题
(5) 克服这种障碍的方案是什么?采用“分离原理”,将电池“分离”为两个电极室,Zn与稀硫酸分处不同的电极室。
(6) 实现该方案的关键是什么?具有导电作用的隔膜。
1.1 描述问题应准确定义需求与理想解
描述问题先要准确定义需求与理想解。“需求”是指对创新设计方案的定性或定量要求,是人们对所设计的方案或产品的期望。而“理想解”则是指理想状态下的问题解决方案(暂时不考虑客观条件限制),符合“需求”的设计方案。例如,在单液锌铜硫酸电池中,Zn与稀硫酸接触而发生自腐蚀。电池使用完毕,需将金属电极与电解质溶液分开,再用时又得重新组装,非常不便。为解决这种不便,最终的“需求”是设计无需频繁拆装的化学电源。“理想解”是金属电极能与电解质溶液共存(不考虑Zn能与稀硫酸反应的客观条件限制),即可将电极与电解质溶液等材料组合成固定的电源装置。因而准确地定义需求与理想解,为后续分析、解决问题指明思考的方向,从而提高创新设计的效率。
1.2 分析问题需抓住矛盾关系
分析问题需要抓住现实与理想解之间存在的矛盾关系。例如,现实存在的“障碍”是Zn与稀硫酸接触必然发生反应,而“理想解”要求金属电极能与电解质溶液共存,二者存在矛盾。因此,“出现这种障碍的结果”是Zn与稀硫酸溶液不能共存,电源装置在使用前后需要组装、拆卸。通过分析矛盾关系,可以找出原装置(或方案)中需要改进的部分。因而抓住正确的矛盾关系是解决问题的基础,而需要改进的部分则是解决矛盾的方向。
1.3 解决问题可借助发明原理
Altshuller梳理了上万份发明专利后,总结出40条普遍适用的发明原理,用于解决矛盾关系。例如,在不改变电池总反应的前提下,“克服这种障碍”可考虑采用“分离原理”(见表2)——将单液电池“分离”为两个电极室,Zn为负极材料,浸于ZnSO4溶液中;Cu为正极材料,浸于稀硫酸中。而“实现该方案的关键”是具有导电作用的隔膜,发明原理为创新设计提供借鉴,启发改进思路,促进创新的发生。
表2 教学过程所用的部分发明原理及介绍[8]
发明原理原理介绍
分离原理(1) 将物体中的“干扰”部分分离出去;
(2) 将物体中的关键部分挑选出来。
同质性原理用功能相似的物质替代。
抛弃与再生原理(1) 当一个物体完成了其功能或变得无用时,抛弃或修改该物体中的一个元件;
(2) 立即修复一个物体所损耗的部分。
2 基于IFR思维方法的教学设计
2.1 教材分析
高中化学必修课程中的“化学电源”,与“原电池反应的原理”共同构成“化学能转化为电能”的教学主题。学习“化学电源”,可以在应用层面加强对原电池反应原理的理解,从技术角度了解原电池各构成要素的作用与变式,认识“化学能转化为电能”的价值。
针对“化学电源”的教学,新课标建议使用“伏打电池的发现、干电池的改进、燃料电池的应用”等化学电源历史沿革与发展的情境素材,开展“用生活中的材料制作简易电池”等内容的教学活动,达到“能举例说明化学电源提高生活质量”的学业要求[9]。苏教版必修第二册的“化学电源”,通过锌锰干电池、银锌纽扣电池、铅蓄电池、镍氢电池、氢氧燃料电池等化学电源,阐释化学电源的定义及特点,简要介绍化学电源的分类与工作原理的差别[10]。
因此,本节课教学应结合教材内容探索简易电池的制作或方案设计,运用IFR思维方法分析简易电池的制作与改进,开展创新思维训练。
2.2 学情分析
在本节课前,学生已经学过单液铜锌原电池的工作原理,但从“原电池的工作原理模型”到“实际应用的化学电源”,学生的认知还存在较大跨度。他们需要理解“为何需要多种多样的化学电源”及“新型化学电源如何诞生”等问题,才能深刻体会化学电源对人类生产生活的重要作用。
高一学生正处于抽象逻辑思维发展的重要阶段[11]。在课堂教学中,针对性地开展思维训练,将有助于他们体验运用对比、分析、演绎、推理等思维活动,跳出旧框架,提出新颖独特的思考与见解。在学习“化学电源”时,学生可通过微项目的方式体验科学家解决实际问题的过程,运用IFR思维方法构建创新思维模型,发展创新思维能力。
2.3 教学目标
(1) 通过实验探究单液铜锌原电池,认识化学电源的概念及特点,评价其缺陷,提出改进方案。
(2) 通过自制“不用反复拆装”“携带方便”的化学电池,设计“反复使用”的化学电池等微项目活动,探究原电池各构成要素对化学电源性能的影响,知道化学电源的分类,认识一次电池、二次电池和燃料电池的特点及其在生产生活中的应用。
(3) 通过IFR思维方法的应用实践,有序思考技术发明问题,构建技术创新的问题解决模型,发展创新思维能力。
2.4 评价设计
为了解学生创新意识素养的发展情况,设计创新思维行为表现水平评价表(见表3)。在教学活动后进行组内互评,以考察学生创新思维的表现与发展。
2.5 教学流程
基于上述分析与目标设定,教学流程设计见图1。
3 教学过程
3.1 环节一:伏打电堆的诞生
[驱动性任务]讨论伏特(即伏打)从众多金属材料中选中Cu和Zn作为电极材料的原因。
[师生活动]学生猜想可能是Cu与Zn的金属活泼性相差较大,故伏特选择它们作为电极材料。通过分组实验对猜想进行验证,从Cu、 Fe、 Zn、 Mg等电极中,任意选择2种电极与稀硫酸组装成电池,尝试点亮额定电压为1.5V的小灯泡。实验结果显示,负极金属越活泼,电池的电压越大,见表4。但负极所用金属材料确定时,电池电压的大小与正极材料的金属活泼性关系不大。因此,伏特选择Zn作为负极材料(Mg发现于1808年,而伏打电堆发明于1800年),Cu是电的良导体而作为正极材料。
设计意图:通过驱动性任务,让学生意识到原电池的性能指标需符合实际需求,适用于生产生活,才有制成化学电源的价值。负极材料(反应物)的还原性,是影响化学电源性能的重要因素之一。在探究活动中,遇到方向明确、变量较少的创新活动时,试错法仍是一个很好用的创新思维方法。
3.2 环节二:从伏打电堆到丹尼尔电池
[驱动性任务]结合实验,找出简易铜锌原电池的不足并改进。
[师生活动]经过合作、讨论,学生能列举简易铜锌原电池的不足之处,如“锌的表面有气泡生成,有损耗,能量转化率低”“需频繁拆装电池,用时组装;用完需马上拆除,并及时清洗、干燥电极”等。但如何针对不足进行改进,学生毫无头绪。教师结合改进需求,示范用IFR思维方法分析提出解决方案,介绍IFR思维方法。
[演示实验]通过实验验证改进的方案。用三层滤纸隔开H型电解槽的两个电极室,按方案组装仪器,并在正极室加入石蕊显色,见图2。
[实验现象]左室溶液呈红色,右室溶液为无色;闭合回路,Cu片表面有气泡生成,Zn片表面无气泡,红色溶液未进入右室;2min内,电压和电流基本上恒定在0.931V和0.032A。
设计意图:通过驱动性任务,让学生意识到化学电源是能够较长时间稳定、持续地将化学能转变成电能的装置。性能良好的导电性隔膜,如离子交换膜、质子交换膜等,是化学电源的重要组成之一。在探究活动中,学生进行创新思维训练,体验IFR思维方法。
3.3 环节三:从湿电池到干电池
[驱动性任务]分析自制铜锌双液电池的缺点,思考如何改进。
[师生活动]经过合作、讨论,学生列举自制铜锌双液电池的优缺点。优点是一定时间内,避免电极反应物的损耗,电压和电流较稳定。缺点是长时间使用,H+仍将穿透滤纸,与Zn接触,若改用高性能离子交换膜可以得到改善,但不便携带,需进一步改进。学生运用IFR思维方法进行分析,发现携带方便的化学电源需要封闭的体系,自制铜锌双液电池会产生氢气从而无法封闭,因此需要更换氧化剂,使电池反应不产生气体,见表5。进一步讨论后,学生从NaClO、 FeCl3、 MnO2等氧化剂中,选择MnO2作正极反应物,并以NH4Cl为电解质代替稀硫酸。