碳酸氢钠、碳酸钠与酸反应实验的新设计
作者: 丁小婷 陈凯
摘 要:利用注射器、矿泉水瓶、紫甘蓝汁、气球等材料改进碳酸氢钠、碳酸钠与盐酸反应的实验。设计不同质量碳酸氢钠、碳酸钠分别与醋酸反应的实验,从气球变化、液体颜色变化、反应后固体剩余情况等视角观察实验现象。当碳酸钠过量时,发现气球先变大后变小,通过测定生成的二氧化碳的质量分析产生该现象的原因,并用pH传感器测定碳酸钠溶液吸收二氧化碳过程的pH变化。从“被反应完的物质、证据、推理”三个视角设计评价量表,对学生活动给予反馈。
关键词:碳酸氢钠;碳酸钠;实验创新;实验改进
文章编号:1005-6629(2024)09-0082-05
中图分类号:G633.8
文献标识码:B
1 实验设计理念
《义务教育化学课程标准(2022年版)》要求:教师应积极开展以实验为主的多样化的学科活动,促进科学思维培养,实现从知识为本到素养发展的课堂教学转变[1]。为了便于学生进行分组实验或家庭实验,本研究对教材实验从生活取材、多重表征两个维度进行创新设计。
设计实验应注重教学应用。首先需体现“教-学-评”一体化的设计理念,因为实验不只是演示,更多的应该是学习体验;实验也不只是操作,更多的是思维提升[2];实验需要评价给予反馈,但更需要评价给予思考的方向。其次需体现学科育人的理念,包括基于观察实验现象的美育、自制仪器动手操作的劳育、关注思维提升解决问题的智育和关注思想品质科学态度的德育四个方面。
2 实验设计目标
(1) 利用生活易得的素材改进教材中的酸碱盐主题实验,使实验过程更直观、安全,实验现象更丰富。
(2) 超越教师演示,提供以学生为中心的科学实践活动思路。
(3) 在创新实验基础上关注过程性评价,提供教、学、评一体化的设计思路。
3 实验原理
实验中涉及的主要反应的化学方程式如下:
碳酸氢钠与盐酸反应:NaHCO3+HCl====NaCl+H2O+CO2↑;
碳酸钠与盐酸反应:Na2CO3+2HCl====2NaCl+H2O+CO2↑;
碳酸氢钠与醋酸反应:NaHCO3+CH3COOH====CH3COONa+H2O+CO2↑;
碳酸钠与醋酸反应:Na2CO3+2CH3COOH====2CH3COONa+H2O+CO2↑;
碳酸钠溶液吸收CO2:Na2CO3+H2O+CO2====2NaHCO3。
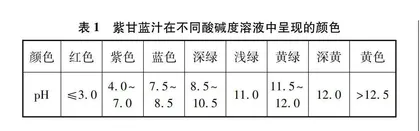
紫甘蓝汁是一种生活中常见的指示剂,在不同酸碱度溶液中呈现的颜色如表1所示[3]。
4 实验过程及现象
4.1 教材实验改进
4.1.1 教材实验分析
人教版化学九年级(下册)第十一单元课题1中涉及NaHCO3、Na2CO3与盐酸反应的实验。教师在演示实验时可能会遇到以下三个问题:(1)反应速率较快,导致混合物从试管中喷出。(2)反应速率较快导致来不及将生成的气体通入澄清石灰水中或没有收集到足够的气体而看不到澄清石灰水变浑浊。(3)无法直观比较NaHCO3、Na2CO3与盐酸反应的剧烈程度。
4.1.2 改进实验方案
利用气球、注射器、紫甘蓝汁对教材实验进行改进,改进装置如图1所示。
4.1.3 实验步骤
(1) 分别量取5mL盐酸于2支试管中,并加入15滴紫甘蓝汁。
(2) 在气球中分别加入0.5g NaHCO3和Na2CO3固体,并将气球套在试管口上。
(3) 将气球中的固体同时倾倒入试管中。
(4) 用盛有20mL澄清石灰水的注射器抽取气球中的气体,振荡。
4.1.4 实验现象
(1) 盛有碳酸氢钠的气球变大更快。
(2) 加入NaHCO3和Na2CO3的试管中反应后溶液颜色分别为红色和蓝色。
(3) 注射器中澄清石灰水变浑浊。
4.1.5 改进实验优点
(1) 反应过程中不会有混合物喷出。
(2) 用注射器抽取气球中的气体与澄清石灰水反应,现象明显,且无需考虑反应太快问题。
(3) 通过气球的变化能直观比较NaHCO3、Na2CO3与盐酸反应的剧烈程度。
(4) 加入紫甘蓝汁,借助颜色变化可表现出反应过程中溶液的酸碱性变化,并结合反应后固体剩余情况进行分析,可以引发更多的思考。
4.2 学生活动设计
4.2.1 实验用品
1mol/L醋酸、NaHCO3、Na2CO3、紫甘蓝汁、气球、矿泉水瓶等
4.2.2 实验步骤
(1) 将25mL醋酸和2mL紫甘蓝汁加入矿泉水瓶中(共10份)。
(2) 在一组气球(5个)中分别加入0.70g、1.05g、2.10g、3.15g、4.20g的NaHCO3,并将气球分别套在上述5个矿泉水瓶口上。
(3) 在另一组气球(5个)中分别加入0.44g、0.66g、1.33g、1.99g、2.65g的Na2CO3,并将气球分别套在另外5个矿泉水瓶口上。
(4) 将气球中的固体同时倾倒入矿泉水瓶中,振荡。
上述每组实验进行3次,记录NaHCO3、Na2CO3与醋酸反应前后气球的变化,以及反应30分钟后的现象。
4.2.3 实验现象
实验现象见表2。
特殊现象:NaHCO3和醋酸反应的实验结束一段时间后,气球无明显变化,而Na2CO3和醋酸反应的实验中,最后一个气球一段时间(约30分钟)后有明显变小的现象,且溶液由绿色逐渐变为蓝绿色。
4.2.4 实验结果分析
定量分析(1):通过称量反应前后装置的总质量,包括矿泉水瓶、NaHCO3、Na2CO3固体、醋酸、气球、生料带(封口用)等所有实验用品。计算每套装置反应前后质量的差值,即为生成CO2的质量。具体数据见表3。
根据所得数据绘制不同质量的NaHCO3、Na2CO3分别与等体积等浓度的醋酸反应生成CO2质量的变化图(如图2所示)。
由图像可知:随着NaHCO3质量的增加,生成CO2的质量先增大后基本不变。随着Na2CO3质量的增加,生成CO2的质量先增大后减小。
NaHCO3质量为2.1g时与1.5g的醋酸恰好完全反应,通过计算得出理论上生成CO2的质量为1.1g。在教学中可以引导学生将实验测定值与理论值进行比较,分析可能产生误差的原因,如有少量反应物固体留在气球中、醋酸挥发等。
定量分析(2):根据图像从定量角度分析Na2CO3过量时气球变小的原因,即装置内CO2减少。
4.3 探究Na2CO3溶液吸收CO2过程
2.65g Na2CO3与醋酸反应后的装置中有较多的固体残留,液体呈绿色,说明Na2CO3浓度较高。一段时间后气球明显变小是否说明Na2CO3溶液也可以吸收CO2?借助pH传感器进行深入探究。
4.3.1 实验用品
饱和Na2CO3溶液、CO2、气球、磁力搅拌器、三颈烧瓶、pH传感器、数据采集器、电脑等
4.3.2 实验步骤
实验装置见图3。
(1) 在三颈烧瓶中加入300mL饱和Na2CO3溶液。
(2) 在瓶口1、2处分别套上充有CO2的气球(气球脖颈用细线扎紧)。
(3) 解开气球1上的细线,让CO2将三颈烧瓶中的空气排出,并用燃着的木条在瓶口3处验满。实验装置如图3a所示。
(4) 在瓶口3处塞上带有pH传感器的塞子,并将气球1换成塞子,再解开气球2的细线。
(5) 打开磁力搅拌器,并在电脑上点击开始采集。实验装置如图3b所示。
4.3.3 实验现象及分析
(1) 气球现象及分析:实验中可以清晰地观察到气球逐渐变小、变瘪,最后甚至进入烧瓶中向内鼓起,说明Na2CO3溶液可以吸收较多的CO2,使瓶内的压强逐渐减小。
(2) 溶液pH变化及分析:溶液pH的数值由10.25逐渐减小至9.93,虽有减小但不明显,如图4所示。随着反应的持续进行,pH还在不断下降。说明Na2CO3与CO2、H2O反应生成了NaHCO3。
5 学生实验活动及评价
实验应以学生为本,所以将单纯演示NaHCO3与酸的反应,拓展为让学生操作、思考和回答问题,并依据一定规则实施评价。除了传感器之外,其他
均来自普通实验仪器或生活中的用品,安全、易得,便于学生自行探索或在课堂上通过教学互动进行考核。为了体现对学生的实验评价,在国外文献[4]的启发下从“被反应完的物质、证据、推理”三个视角设计了评价量表(见表4),考察学生的观察分析和证据推理能力。
6 结语
本实验是基于初中阶段化学知识而设计的,综合性较强,可以用于酸碱盐的新课教学,也可以用于中考的复习课。如果将这个实验的教学延伸应用到高中,还可以用pH传感器检测醋酸与碳酸钠恰好反应时溶液的pH,或者分析当紫甘蓝检测为紫色时溶液实际的pH,可引导学生展开更多的实验探究。
参考文献:
[1]中华人民共和国教育部制定.义务教育化学课程标准(2022年版)[S].北京:北京师范大学出版社,2022:4.
[2]陈凯,马忠杰,王小锋.江苏省中小学生实验能力大赛高中化学学科总决赛实验操作题命题特点分析[J].化学教育(中英文),2024,45(7):121~122.
[3]夏琴,杨砚宁,毛明.利用紫甘蓝汁和pH传感器探究二氧化碳与氢氧化钠溶液的反应[J].化学教学,2016,(10):39~41.
[4]Walker J P,Sampson V,et al.. A Performance-Based Assessment for Limiting Reactants [J]. Journal of Chemical Education,2011,(88):1243~1246.