基于化学史情境的单元复习教学
作者: 曹晶伟
摘 要: 以“原子结构与元素性质”的单元复习课为例,分析单元教学内容,提炼核心概念。选取“稀有气体”化学史情境与教学内容相关的素材,梳理课堂问题、建构教学框架,围绕“位”“构”“性”的三维认知模型开展教学设计。教学实践表明,基于化学史情境开展单元复习教学,有利于激发学生学习兴趣,增强学生知识应用的能力,促进学生对科学本质的理解。
关键词: 化学史情境; 单元复习; 原子结构与元素性质
文章编号: 10056629(2024)12006307
中图分类号: G633.8
文献标识码: B
化学史情境是一种以历史事件或科学发现为背景的教学方法。通过讲述化学发展的历程和科学家的贡献,带领学生体验科学探究的过程,帮助学生更好地理解和掌握化学知识。单元复习课是学生在学习化学课程过程中不可或缺的一环。通过设计单元复习教学可以帮助学生巩固所学知识,构建知识体系,强化学生对基本原理和核心概念的理解。在高中化学单元复习课上引入化学史情境,可以增加学生的兴趣和参与度,培养学生在科学领域的才能,加深学生对化学概念的理解和应用能力,促进学生对科学本质的理解。
1 教学设计思路
“原子结构与元素性质”属于普通高中化学选择性必修课程模块2“物质结构与性质”中主题1的内容,所涉及的主要内容如下:原子核外电子的运动状态、核外电子排布规律、核外电子排布与元素周期律(表)等。本章的教学主题具有内容抽象、理论性强的特点。教学过程中要基于学生已有认知水平,通过具体直观的实例和模型,引导学生理解抽象的概念。
在此之前,学生虽已完整学习了第一章的全部内容。但由于本章节内容抽象复杂,学生所掌握的知识相对孤立而缺乏体系,没有形成完整的知识框架。这些问题有待于在本节课中进一步解决和完善。梳理单元核心概念是本节课的核心任务。在以往的单元复习课教学中,教师常采用条目式的复习方法,这一复习方法往往局限于“炒冷饭”的模式,不利于调动学生的学习热情,也很难帮助学生重新构建知识体系。因此,如何合理安排教学内容,在教学过程中逐一呈现本单元的核心知识,将抽象难懂的学科概念内化为学生的学科核心素养是本节课的重要课题。
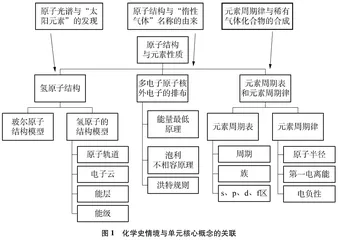
为了突破上述教学难点,本案例通过创设适宜的化学史情境,改变以往条目式的复习课模式,激发学生的学习热情,切实增强复习课的教学效果。通过梳理整合,本案例将稀有气体化学史情境与单元核心知识进行了如下关联:(1)以“太阳元素的发现”为化学史情境载体,复习原子光谱的形成原理和主要特点;(2)以“惰性气体名称的由来”为化学史情境载体,复习原子结构和核外电子排布的规律;(3)以“稀有气体化合物的合成”为化学史情境载体,复习第一电离能、电负性等元素性质的递变性规律。梳理化学史情境与单元核心概念的关联如图1所示。
以稀有气体的发现史、稀有气体化合物的探索史、稀有气体名称的历史演变等化学史实为教学线索,以原子结构与元素性质为知识载体,引导学生综合运用本章知识,展开稀有气体元素及其化合物的探究。本节课设计的教学流程如图2所示。
2 教学目标
《普通高中化学课程标准(2017年版2020年修订)》指出[1],在实施“原子结构与元素性质”单元教学时,教师应注重帮助学生建立基于“元素位置”“原子结构”“元素性质”(以下简称为“位”“构”“性”)关系的系统思维框架,提高学生分析和解决问题的能力。通过新授课的学习,学生已初步建立“位”“构”“性”的三维认知模型,但对该模型的认知大多仅停留在表层,尚缺乏应用“位”“构”“性”模型分析、解决实际问题的体验,难以深入体会科学理论模型的建立对科学研究的意义和价值。本节课以稀有气体元素的发现、结构和性质的探究为主线,帮助学生进一步发展“位”“构”“性”的三维认知模型,将相关知识结构化,进而形成完整的知识框架。基于以上分析,本节课确定教学目标如下:
(1) 通过分析稀有气体原子结构与元素性质的关系,理解原子结构对元素性质、元素在周期表中位置的决定性作用,进一步发展“位”“构”“性”的三维认知模型。
(2) 借助元素周期律分析、预测稀有气体元素的性质,推测最易合成的稀有气体化合物,体验化学科学研究的思维过程,深刻感悟元素周期表在科学研究中的重要价值。
(3) 通过了解稀有气体元素的发现及其名称演变等化学史实,认识科学的认知是不断创新和发展的,深入体会科学家追求真理、勇于探索的科学精神。
3 教学实施
3.1 创设化学史情境
[化学史情境]在元素周期表的p区,存在着这样一族元素,它们性格冷淡,善于躲藏。1869年,门捷列夫在编制第一张元素周期表时,人们甚至还没有发现它们的存在。直至1894年,这一族中的元素才陆续被化学家们所发现。自发现以来,随着化学家对它们结构与性质了解的不断深入,这一族元素的名称也多次更改。你知道它们是什么元素吗?这些元素又具有什么样的性质特点呢?
[明确任务]在本节课中,我们将综合运用本章所学知识:原子结构、核外电子排布的规律、元素周期表和元素周期律等知识来深入了解这一族特殊的元素。
设计意图:创设“神秘元素是什么”这一化学史情境,激发学生的探索欲和求知欲。明确复习的核心任务,唤醒学生原子结构与元素性质的知识碎片。
3.2 探究一:原子光谱与“太阳元素”的发现
[化学史情境]1868年,法国天文学家简森在利用分光镜观察日全食时,发现了一条波长为587.49nm的特殊的黄色谱线[2]。同年,英国天文学家洛克耶在观察太阳光谱时也发现了这一条特殊的黄色谱线。我们知道每一种元素的原子发射光谱都会有其各自确定的特征谱线。而波长为587.49nm的这一条谱线不属于当时已知的任何一种元素的原子光谱。洛克耶认识到,这很有可能是一种待发现的新元素。由于当时新元素还没有在地球上被发现,于是洛克耶便把这种新元素命名为Helium,来自希腊文helios(太阳),中文译名为“氦”,意为太阳元素。
[核心问题1]特征黄色谱线帮助科学家发现了氦元素。请你回忆,原子光谱为什么是线光谱?
[教师讲解]原子核外的电子处在不同的轨道中,不同轨道间的能量差是确定的、不连续的。当电子在不同轨道间跃迁时,就会以光的形式吸收或放出相应能量,而轨道间的能量差又决定了光辐射的波长,因此原子光谱表现为特定的线光谱。
[核心问题2]为什么不同元素的原子光谱各不相同呢?
[学生回答]这是因为不同元素原子的核电荷数和电子数不同。一方面电子受到来自原子核的吸引作用,另一方面电子相互之间又存在排斥作用,这就使得电子受到的影响和作用各不相同,所以原子轨道的能量及其差值也就不同,于是光辐射的波长也各不相同,最终使得不同元素的原子光谱各不相同。
[师生讨论]通过以上讨论,我们认识到原子的结构决定了原子光谱。反过来,原子光谱也反映了原子的内部结构。根据不同元素原子光谱的特征性,人们可以鉴定、甚至发现新元素。
[化学史情境]遗憾的是,早期化学界普遍持有的观念是“只有拿到实物才算发现”,而对于通过光谱发现的物质,并没有给予高度的重视和肯定。这让“太阳元素”的发现延迟了27年。直到1895年,英国化学家拉姆齐在用硫酸处理沥青铀矿时,产生了一种不活泼的气体[3]。后来,经过科学家的仔细比较,发现这正是1868年简森和洛克耶发现的“太阳元素”——氦。
设计意图:创设稀有气体发现史的情境,启发学生思考原子结构与原子光谱的关系,复习原子光谱的特点和形成原理,帮助学生构建“构”的一维认知模型。
3.3 探究二:原子结构与“惰性气体”名称的由来
[化学史情境]此后,这一家族的其他元素也陆续被发现了。如何称呼它们呢?最初它们被称为稀有气体元素(rare gases),因为化学家们认为它们是很罕见的。不过这种说法只适用于其中部分元素,并非家族中的所有元素都很少见。例如,氩气在大气层中的含量占0.93%,远胜于二氧化碳的0.04%。又如,前面我们所提到的氦,在宇宙中的含量仅次于氢。那么这些元素还有什么共性呢?没错!化学性质稳定。于是,化学家们又把它们改称为惰性气体(inert gases),表示它们化学性质稳定,难以和其他元素反应形成化合物。
[核心问题3]那么,为什么稀有气体化学性质如此稳定呢?
[师生讨论]结构决定性质。要分析稀有气体的化学性质,我们首先要讨论它们的原子结构特点:稀有气体元素原子的最外层均达到了8电子稳定结构,当然He原子是2个电子。从核外电子排布的角度看,最外层8个电子的原子,它们的价电子排布式通式为ns2np6,其中He是1s2。
设计意图:帮助学生进一步体会原子结构对元素性质的影响,强化“构”“性”二维认知模型:原子核外电子的排布对元素化学性质起到了决定性的影响,也正是稀有气体元素原子最外层电子的全充满结构决定了其稳定的化学性质。
3.4 探究三:元素性质与稀有气体化合物的合成
[核心问题4]既然稀有气体最外层电子已经达到了稳定结构,那么它们还能形成化合物吗?
[教师引导]要有新化合物的生成,就一定要有新化学键的形成,这就需要稀有气体元素的最外层电子参与到化学键的形成。大量实验表明,稀有气体元素的原子难以通过得到电子形成化学键。那么,让它们失去电子的方案是否可行呢?
稀有气体元素原子失电子能力各不相同,显然,我们应当选取最容易失去电子的稀有气体元素来进行研究。上节课我们介绍了一种能够定量地比较原子失电子能力的方法,你还记得它的名字吗?没错,是第一电离能,基态的气态原子失去一个电子所需要的最低能量。
[核心问题5]如图3所示,展示了部分元素的第一电离能变化趋势[4]。请你根据同族元素第一电离能的递变性规律,推测哪一种稀有气体元素最有可能与强氧化剂发生反应(放射性元素除外)?
[学生回答]第五周期的氙元素,第一电离能最小,最容易失去电子,最有可能发生反应得到化合物。
[化学史情境]实际上,诺贝尔化学奖获得者——鲍林在1933年就预言过氙的化合物应该存在。他认为,氙是除了放射性元素氡之外原子半径最大的稀有气体原子,它的原子核对核外电子的吸引力并不像其他的稀有气体那么大,所以极有可能与反应活性较高的元素反应。科学家们采取了多种方法试图合成氙的化合物,可惜的是,都没有成功[5]。
1962年,英国化学家巴特利特在研究无机氟化物时,发现六氟化铂(PtF6)和氧气反应生成六氟合铂酸氧{O+2[PtF6]-}。巴特利特由此推断出六氟化铂是一种非常强的氧化剂,因为它能够将氧气氧化生成二氧基正离子(O+2)。在相关查询资料后,巴特利特发现氧气到二氧基正离子的电离能(1165kJ·mol-1)与Xe到Xe+的电离能(1170kJ·mol-1)相差不大,且O+2与Xe+离子半径大小接近,于是巴特利特尝试用六氟化铂氧化氙气。当巴特利特将六氟化铂和氙气适量混合后,反应得到了橙黄色的固体六氟合铂酸氙(XePtF6)。XePtF6是第一种制得的稀有气体化合物,这给当时的化学界引发了一场地震[6]。
巴特利特的报道在世界范围掀起了一股稀有气体热,化学家们在不久之后合成了一系列氙的化合物。甚至成功地用一种非金属单质与氙完成了化合反应。
[核心问题6]请你运用已学知识,推测这可能是哪一种元素的单质,并说明理由。
给同学们一点提示,前面我们已经提到,稀有气体极难通过得到电子形成化学键。而巴特利特的实验已经证实让稀有气体元素参与化学反应、让它失去电子的方案是可行的。那么,哪一种元素的原子最容易夺取稀有气体元素原子的外层电子呢?你可以结合元素周期律来思考这一问题。
[学生回答]可以借用元素的电负性数据来进行分析。元素的电负性越大,表示原子在形成化学键时吸引电子的能力越强。元素周期表中氟元素的电负性最大,氟原子可以强烈地吸引氙原子最外层的电子,氟气与氙气的反应最有可能发生。