对电解质概念教学若干问题的思考
作者: 程俊 兰建祥
摘要: 基于在电解质概念教学课后学生暴露出的四类典型问题,提出五个优化教学的策略:优化教学内容的结构化组织,突出溶液导电性实验的证据功能,通过科学史强化学生对电离与导电关系的认识,
展现电解质在日常生活中的无处不在,
彰显离子视角分析溶液问题的重要性。
关键词: 电解质; 概念教学; 核心素养; 高中化学
文章编号: 1005-6629(2023)04-0028-05
中图分类号: G633.8
文献标识码: B
电解质作为极其重要的一类化合物,涵盖了化学课程中的元素性质、反应原理、物质结构三大知识板块,堪称中学化学课程内容的主角。理解电解质概念是高中学习电解质相关知识的起点,对电解质概念的理解程度在很大程度上将影响着后续的学习。所以,电解质概念的教学一直以来备受关注和重视。但是,由于概念本身具有抽象性、电离过程具有微观特征,尤其是学生缺乏物质结构的知识而致使认知水平受限,这些都成为学生从本质上理解电解质概念和电离微观过程的障碍。
在《普通高中化学课程标准(2017年版2020年修订)》(以下简称“新课标”)的背景之下,电解质概念教学又呼唤着两大“新意”——教学设计要着眼于电解质在高中化学课程中具有的统摄意义,要着眼于电解质教学承载的发展学生学科核心素养的价值。为此,结合多年教学实践,基于“新课标”教学理念,尝试对电解质概念教学的相关问题做一个系统性思考,并对教学改进提出一些商榷性建议。
1 电解质概念在高中化学课程中具有统摄意义
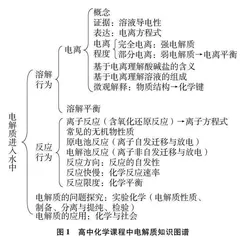
电解质是一种让化学家着迷的物质,也是近代化学研究的起点,电解质的研究让世界迈入了由化学能转化为电能的神圣时代。在高中化学课程中,必修课程中的五个主题、选择性必修课程中的三个模块、选修课程中的三个系列,很大程度上是侧重于从不同角度研究电解质的概念、电解质的微观结构、电解质溶于水的电离行为、电解质在溶液中发生的化学反应(包括电化学反应)、电解质在溶液中存在的化学平衡等。所以,电解质是名副其实的高中化学课程内容主角,电解质概念在高中化学课程中具有显著的统摄意义,可以用图1把这种统摄意义呈现出来。
由此可见,电解质的知识关联到高中化学中的元素性质、化学反应原理、物质结构与性质、实验化学、化学与社会等主要板块,涵盖除有机化学板块之外的几乎所有领域。电解质知识是高中化学课程内容的基石,电解质概念对这些内容具有统摄性,这种统摄性可以描述为“没有电解质,就没有高中化学课程”。学生通过镶嵌于整个高中化学课程中关于电解质的进阶性学习,对电解质内涵的理解、建构不断得以丰富、内化和深化。
2 电解质概念教学承载的核心素养发展价值
在新课程背景下,学科教学要以“素养为本”,着力发展学生的学科核心素养,为学生的终身学习和发展服务。在高中化学教学中,电解质概念作为课时教学内容,主要包括电解质概念、电离概念与电离方程式的书写、基于电离理解酸碱盐的含义等内容要点,是促进学生化学学科核心素养形成和发展的重要载体。对标“新课标”中凝练的五个方面的学科核心素养,对电解质概念承载的教学价值理解如下。
(1) 发展“宏观辨识与微观探析”素养。“宏观辨识”指向电解质溶液态或熔融态时的导电性,“微观探析”指向电解质在溶液中解离成自由移动的离子状态;发展“宏观辨识与微观探析”素养,就是引导学生建立宏观层面上溶液的导电性与微观层面上离子的自由移动之间的联系,促进学生形成宏微结合分析问题的视角。在中学化学课程中,电解质溶液的性质主要包括:溶液的导电性、溶液的微观组成、溶液中的化学反应、溶液中的三大平衡、溶液的电化学性质(包括原电池与电解池)等,这些性质有待在不同的课程模块和主题中进行专题学习,且不同学习阶段有着不同的学业质量要求。研究和理解溶液的这些性质,最为重要的就是基于离子或分子等微观视角。
(2) 发展“变化观念与平衡思想”素养。发展“变化观念”素养,就是认识电解质溶于水或熔融时发生电离(在水溶液中还要形成水合离子),并且认识到这个变化是有条件的——电解质溶于水或熔融即电离的条件;甚至还要认识到,这个变化过程中伴随着能量的变化,表现为溶液温度升高或降低。通过认识这些变化,促进学生形成变化的观念和动态分析变化的视角。至于“平衡思想”素养,有待后续学习中以电解质的电离平衡、水解平衡、沉淀溶解平衡等为载体来进行培育。
(3) 发展“证据推理与模型认知”素养。“证据推理”指向电解质溶液或熔融态时的导电性,“模型认知”指向电离方程式的书写。发展“证据推理与模型认知”素养,就是引导学生基于导电性实验来理解结论与证据之间的逻辑关系,并运用电离方程式来表示电离行为,以及解释电解质溶液或熔融态的导电性。
(4) 发展“科学探究与创新意识”素养。“科学探究”指向著名的迈克尔·法拉第和阿伦尼乌斯之争——NaCl溶液中形成自由移动的离子是产生于电流作用还是水分子作用?发展“科学探究与创新意识”素养,可以把“NaCl溶液中发生电离的机理”设计成探究活动,引导学生提出假设并运用控制变量方法设计实验进行探究,鼓励学生敢于质疑、勇于创新。
(5) 发展“科学态度与社会责任”素养。“科学态度”指向电解质概念的发展史、电离理论的发展与演进过程。发展“科学态度”素养,就是引导学生认识科学理论建立的曲折动态发展过程,感悟科学家在研究过程中的科学思维与探究方法、探索真理的艰辛历程,欣赏科学家在科学研究过程中敢于质疑、勇于创新、探索未知、崇尚真理的科学精神。
3 电解质概念教学的效能反馈
从既往教学实践来看,电解质概念的教学效果常常是差强人意的,这种教学效果表现为学生在课堂提问评价、课后作业评价与测查中暴露的各种问题,并且由于后续元素化合物学习的多样性,这些问题在教学和作业中很难回避。现将学生在学习电解质之后暴露的主要问题整理如下:
(1) 关于“是否为电解质”的辨析出现问题。主要包括:①把具有导电性的物质(包括金属单质、某某溶液)判断为电解质;②把溶液具有导电性的SO2、 NH3等判断为电解质;③把难溶于水的盐类物质(如AgCl、 BaSO4等)判断为非电解质;④对CuO、 Al2O3等金属氧化物是否为电解质认识不清。
(2) 关于“导电性”的分析出现障碍。主要包括:①不能判断液态HCl、 H2SO4等是否导电;②不能理解熔融态NaCl、 Al2O3等为何能导电;③不能分析溶液在发生化学反应前后导电性的变化,如向Ba(OH)2溶液中通入CO2、向H2SO4溶液中滴加Ba(OH)2溶液等的过程中,溶液导电性如何变化。
(3) 关于“电离与导电关系”的理解出现差错。主要问题是:部分学生把“电离与导电关系”误解成“先有通电,后有电离”、“是因为通电才电离”,认为“通电是电离的条件”,甚至在潜意识中把电解质理解成“水溶液通电后能发生电离的化合物”“是其水溶液能导电的化合物”,也有学生认为“电解质的水溶液一定能导电”“水溶液不能导电的化合物肯定不是电解质”等,对“电离与导电关系”存在迷思认识。
(4) 关于“电离方程式”的书写存在困惑。主要包括:①不能区别NaHSO4溶于水与熔融时电离方程式的区别;②错误写出CuO、 Al2O3等金属氧化物在水中的电离方程式;③错误写出HCl、 H2SO4等共价型化合物在熔融状态下的电离方程式。这些困惑的存在,将直接影响学生对后续离子方程式的正确书写。
4 电解质概念教学的几点商榷
学生在学习电解质概念中暴露的问题,实则教师需要正视、值得反思、有待改进的问题,其中有些问题更是电解质概念教学中面临的长期困境。
4.1 优化教学内容的结构化组织
在电解质概念的教学中,教学内容涉及电解质、强电解质与弱电解质、电离与电离方程式等概念,其中的电解质又包括常见的酸、碱、盐和金属氧化物等四种类别的物质,这使得教学内容具有繁杂的特点,从而给教学内容的组织带来挑战。在传统教学中,一般是按照酸、碱、盐和金属氧化物的分类,选取四类物质的代表物逐一讲授其电离情况,而且还要分为溶于水和熔融状态下两种情形来分析,这就导致一个课时内很难完成教学任务,有的教师甚至干脆用两个课时来完成电解质概念的教学。而且,物质类别的纷繁复杂还会给学生带来认知上的负担,极易造成学生认知上的混乱,进而影响学生的学习效能。
为此,特别需要对纷繁杂乱的教学内容进行高度的结构化组织,为教学的内容“瘦身”,为学生的理解“减负”。为此,我们不妨先思考:在传统教学中,为何要按照酸、碱、盐和金属氧化物的分类,选取四种代表物逐一分析其电离情况?这是因为,学生在学习电解质概念时,正处于学习高中化学的起始阶段,还完全不具备化学键的相关知识储备——这也是电解质概念教学面临的最大困境所在。也正是因此,导致学生难以从微观本质上理解“电解质溶于水或熔融时究竟发生了什么”,难以从物质结构的角度理解电离的微观过程。这也是造成学生在学习电解质概念之后,依旧不能熟练辨析陌生化合物“是否为电解质”的原因所在。
在初中化学的学习中,学生已经了解到构成物质的基本微粒有原子(如金属单质)、分子(如氧气、二氧化碳)与离子(如氯化钠)。基于此,可以引导学生依据构成物质的基本微粒,把化合物分为离子型和分子型两种基本类型(无需引入离子化合物与共价化合物概念),在这样的分类视角之下,就可以把电解质区分为离子型和分子型两类来研究。这样一来,教学中就只需要选取两种代表物(通常选取NaCl和HCl作为代表物)来研究它们的电离行为,从而可以把宝贵的课堂时间更多用于探讨以NaCl和HCl为代表的两类物质的电离。
这种分类完全处于学生可以接受的认知水平,不仅有效解决教学内容过于繁杂的问题,而且更有利于学生从本质上理解这两类电解质电离的差异性。虽然难以引入化学键、离子键、共价键等陌生概念描述微粒间的相互作用,但可以将其简单描述为“微粒间的相互作用”,并引导学生认识到,电离就是微粒间的相互作用被水分子或熔融条件破坏了而发生的,使得学生对电离的理解更加接近微观本质。
4.2 突出溶液导电性实验的证据功能
“电解质的电离”是培养学生“宏观辨识与微观探析”素养的重要内容载体,溶液导电性实验是微观过程与宏观现象沟通的桥梁。故此,导电性实验是电解质概念教学中不可或缺的教学内容。
在常规教学中,教师习惯把导电性实验的功能定位成“检验导电性”,对实验的这种功能定位实则不准确。该实验直接呈现出来的现象的确是导电性,的确是检验了物质的导电性。但是,这样的功能定位,带给学生的认知是:导电性是电解质的基本属性,并且容易造成学生将是否导电作为研究电解质的重要角度[1]。相反,如果把导电性实验功能定位成“验证是否存在自由移动的离子”,这样更有利于学生基于电离的视角来理解电解质溶于水的行为、理解电解质概念的本质。这样的功能定位,使得实验的验证功能更加准确,使得实验更加凸显其功能价值。
在电解质概念教学中,为了强化导电性实验的功能是“验证溶液中是否存在自由移动的离子”,我们可以将导电性实验作为验证性实验来呈现:向学生提出“NaCl溶于水后,其中的离子会发生什么变化”的问题,引导学生对NaCl固体溶于水之后的存在形态提出假设:(1)Na+与Cl-不能自由移动;(2)Na+与Cl-能自由移动,然后引导学生运用控制变量思想设计并实施对照实验进行假设的验证:(1)NaCl固体导电性实验;(2)水的导电性实验;(3)NaCl溶液导电性实验。根据三个平行实验的探究,得出的实验结论是:NaCl溶解后,Na+与Cl-变成自由移动的离子(提请学生注意:实验结论不是NaCl溶液具有导电性),并引导学生思考“水在这里起了什么作用”。