化学核心素养导向下的命题实践与研究
作者: 江合佩
摘要:以“菱锌矿制备硫酸锌”生产环保情境素材为例,全面展示利用核心素养导向下的试题命制的系统构成模型指导命题的全过程,即以核心素养为测试宗旨,明确考试类别与水平,依据测试目标遴选并适当合理简化真实情境,根据关键能力优化测试任务,梳理必备知识均衡合理分布,以期实现考试由一般评价工具向全面育人载体转变。
关键词:核心素养;真实情境;关键能力;必备知识;试题命制
文章编号:10056629(2023)06008008中图分类号:G633.8文献标识码:B
1 核心素养导向下的命题流程的确定
试题命制应以核心素养测试为宗旨,以真实情境为测试载体,关注情境的价值引领性、素材真实性、形式多样性和呈现的科学性,从日常生活、生产环保、学术探索、实验探究和化学史料等不同类型的素材中遴选情境,通过调控情境的复杂度、陌生度和开放度;以化学知识为解决问题的工具,融入化学语言与概念、反应变化与规律、物质转化与应用、物质结构与性质和实验原理与方法等核心必备知识[1],通过调控知识的综合与关联程度;以实际问题为测试任务,通过单一、指定、提示或自主等不同认识角度进行问题设计,合理分布理解与辨析、分析与推测、归纳与论证、实验与探究等不同能力层阶的关键能力[2]的考查,帮助学生形成完整系统的化学学科知识体系,培养学生的实践和工程设计能力,促进学生高阶思维的养成,自觉形成自主学习和终身学习的意识和能力。
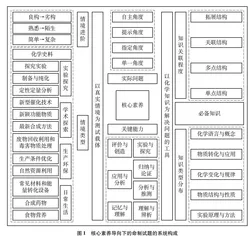
本文根据当前高考及化学学业水平等级性考试价值导向[3],结合命题框架和命题程序[4],融合中国高考评价体系,形成核心素养导向下的命制试题的系统构成,如图1所示。
2 核心素养导向下的命制实践
2.1 明确考试类别与水平,确定测试宗旨与目标
作为学业水平等级性考试命题,根据课程标准要求,主要选择学业质量水平4作为命制的依据。工业流程题的主要功能是通过对物质转化的测试重点发展学生的“变化观念与平衡思想”的核心素养,课标中关于本部分对学生的能力要求是能基于“绿色化学”理念设计无机化合物制备的方案,并对方案进行评价和优化;能分析评估物质转化过程对环境和资源利用的影响。
2.2 遴选真实情境,对素材进行合理加工
工业流程题主要选择生产环保情境作为命题素材,本题以自然界存在的菱锌矿
(主要成分为ZnCO3,常含铁和锰元素,有时含钴、镉、铟等元素)
为原料生产硫酸锌的工艺作为试题情境,体现综合性和应用性的考查要求。硫酸锌在医学上可用作收敛剂、农业上可用作饲料添加剂,彰显化学科学对人类和社会发展的重大贡献,有利于学生树立可持续发展意识和绿色化学观念,体现了教育性。情境来源于化工生产文献,且锌及其化合物相对于学生来说陌生度小,其中蕴含的物质转化涉及的考点覆盖面广,复杂度大、有一定的开放度,较好地体现了真实性。菱锌矿制硫酸锌的工业流程如图2[5~7]所示。
一种菱锌矿主要成分为ZnCO3(19.34%),含SiO2(27.56%)以及Ca(2.9%)、 Pb(1.68%)、 Mg(4.87%)、 Fe(2.6%)、 Al(0.03%)、 Mn(0.13%)、 Cu(0.02%)、 Cd(0.17%)、 As(0.02%)等元素。由于As、Cd两种元素对于学生来说陌生度较大,在氧化剂存在下,砷在净化过程中主要形成FeAsO4(Ksp=5.7×10-21)和Cd3(AsO4)2(Ksp=2.2×10-33)沉淀除去;Cd则在通过加入锌粉发生置换反应除去。其中需要补充的信息和数据过多,容易对主干元素的转化造成干扰,基于以上考虑,调控情境复杂度的时候,将As、 Cd两种元素略去。
整个工艺流程过于庞大,为了体现情境的适切性,将过滤步骤与前一个对应的步骤整合成一个操作。整个流程中滤液、滤渣出现的频率较高且指代的物质各不相同,为了让学生明晰物质的进出,将原流程中的滤液和滤渣分别依次编号,使得学生能够直接抓住流程主干。在用KMnO4氧化之前需对滤液pH进行调节,原流程中没有画出相对应的物质流,为了突出核心操作,在对流程重新加工的时候,特地将其外显出来。原流程是以网状的形式呈现的,篇幅大,需要提取的信息较多,为了使物质的进出更加清晰,特将流程进行重新绘制,以锌元素的净化除杂为主轴、锌元素的二次浸出为辅助,凸显物质转化,外显变化观和守恒观。
2.3 设计测试任务,合理进行设问
在关注了情境的教育性、适切性并合理调控其复杂度以后,根据核心素养测试目标,初步命题试题如下:
硫酸锌是制造多种锌盐,木材防火、防腐剂以及生产立德粉、媒染剂等的重要原料。利用菱锌矿(主要成分为ZnCO3,含SiO2以及Ca、 Pb、 Mg、 Fe、 Al、 Mn、 Cu等元素的化合物)制备ZnSO4·7H2O的工艺流程如下:
Ⅰ. 25℃时,相关难溶物溶度积常数如下表:
Ⅱ. 25℃时,相关金属离子[c0(Men+)=0.1mol·L-1]形成氢氧化物沉淀pH范围如下:
(1) “浸取过滤”中加入H2SO4的目的是________。
(2) “沉铁过滤”中Fe2(SO4)3中加入(NH4)2SO4生成黄铵铁矾[(NH4)2Fe6(SO4)4(OH)12]的化学方程式为________。
(3) 将滤渣①进行“酸浸过滤”“沉铁过滤”的目的是________,后续可将滤液重新回流至“浸取过滤”步骤中。
(4) “调溶液pH=5过滤”中,物质X最适宜的是________(填标号)。
A. NH3·H2O B. ZnCO3 C. NaOH D. ZnO
(5) 向80~90℃的滤液②中分批加入适量KMnO4,Fe2+、 Mn2+分别被氧化为Fe3+和MnO(OH)2,滤渣③中有MnO2,有关反应的离子方程式为________。
(6) “置换过滤”中加入锌粉除去的离子有________。
(7) “沉钙镁过滤”产生的滤渣⑤与Y为________(填化学式)反应释放HF并循环利用。
在具体设计测试任务的时候,要有效地将素材情境与核心知识进行有效地关联,考查学生的学科关键能力。
首先,设问需要确保科学性。由于Al3+在pH=4.7沉淀完全,Zn2+在pH=6.2时开始沉淀,因此加入X调pH=5既可以“沉铝”又不让锌元素损失。在“浸取过滤”步骤强酸性溶液环境中此时加入的物质X调节溶液的pH为弱酸性,应不引入新的杂质且不污染环境。加入NH3·H2O既引入了杂质离子NH+4,又易分解产生NH3污染空气;加入NaOH则引入了杂质Na+,综上加入ZnCO3、 ZnO比较合适。
其次,设问需要注重进阶性。“沉铁过滤”步骤加入(NH4)2SO4生成黄铵铁矾[(NH4)2Fe6(SO4)4(OH)12],根据元素守恒可写出化学方程式“3Fe2(SO4)3+(NH4)2SO4+12H2O====(NH4)2Fe6(SO4)4(OH)12↓+6H2SO4”。在(2)设问进行铺垫以后,再结合表格数据信息Fe2+、 Zn2+开始沉淀和沉淀完全的pH分别为6.3~8.3、 6.2~8.2,因此可以得出“富集Zn2+,降低Fe2+的浓度”。整个设问按照学生认识层级逐级设问,上一问为下一问做好知识铺垫,较好地体现了设问的进阶性。
第三,设问需要体现综合性。高三的学生对氧化还原离子方程式的书写步骤驾轻就熟,“得失电子守恒→电荷守恒→原子守恒”三部曲学生信手拈来,这种孤立地仅从物质转化的视角来书写离子方程式严重影响了学生对其中物质变化的深刻理解,而有效综合融入沉淀溶解平衡实际转化的视角将有利于提升学生对该部分知识的理解。在加入氧化剂KMnO4之前已经调控溶液pH=5,Fe2+被氧化为Fe3+时,还需要结合表格数据Fe3+开始沉淀和沉淀完全的pH为1.5~2.8,很显然,此时Fe3+存在的形态应该为Fe(OH)3,再根据三部曲问题就可以迎刃而解,得到“3Fe2++MnO-4+7H2O====3Fe(OH)3↓+MnO2↓+5H+”,根据Mn2+被氧化为MnO(OH)2,再结合此时溶液pH为5(弱酸性)可写出“3Mn2++2MnO-4+7H2O====5MnO(OH)2↓+4H+”。对2个离子方程式分析可以得出,Fe(OH)3和MnO(OH)2与H+是共存的。通过对该设问的考查,可以帮助学生对离子共存和离子方程式的书写从孤立走向系统,从定性走向定量,从变化观念走向平衡思想。
第四,设问需要探索开放性。注重考查思维过程,通过增强试题的开放程度,鼓励学生多角度、多层次地运用发散性思维分析解决问题,培养学生的学科关键能力。“浸取过滤”中加入H2SO4的目的既要从核心元素Zn的转化进行分析,又要从杂质离子的分离提纯两个视角进行思考。分析核心元素Zn的转化可以得出,“焙烧”阶段是将ZnCO3转化为ZnO,因此采取H2SO4浸取的目的是“溶解ZnO”;从杂质离子的去除来看,加入H2SO4浸取可将Ca、 Pb元素转化为CaSO4、 PbSO4沉淀除去。“置换过滤”中加入锌粉主要是利用金属活动性顺序,很多学生能够很顺畅地分析出将溶液中的Cu2+转化为Cu,但往往会忽略将Pb2+转化为Pb。这种二次沉铅,正是真实工业生产过程中需要考虑的问题,有力地考查了学生思维的缜密性和严谨性。