科学思维:化学探究实验的灵魂
作者: 白建娥 吴琼英
摘要: 科学思维是化学探究实验的灵魂。对铁钉与CuSO4溶液反应pH降低的“异常”现象进行深入探究,设计成时长80分钟的高三复习课。沿着“发现异常→设计方案→分析解释→又见异常→系统梳理→模型内化”六个教学环节层层递进,促进核心知识、认识思路和学科观念结构化,全面提升学生的思维品质。
关键词: 科学思维; 探究实验; 铁与硫酸铜反应; 高三复习
文章编号: 10056629(2023)10005006 中图分类号: G633.8 文献标识码: B
科学思维是在化学学习中基于事实与逻辑进行独立思考和判断,对不同信息、观点和结论进行质疑与批判,提出创造性见解的能力;是从化学视角研究物质及其变化规律的思路方法;是从宏观、微观、符号相结合的视角探究物质及其变化规律的认识方式[1]。科学思维是化学探究实验的灵魂。
由铁钉与CuSO4溶液反应后pH降低,推测发生了反应:4Fe2++O2+10H2O4Fe(OH)3↓+8H+,该“异常”现象此前并未引起太多关注,相关文献只搜索到一篇[2],文献作者在九年级“质量守恒定律”一节的演示实验中发现铁钉与CuSO4溶液反应后pH下降的现象,通过对比实验得出异常现象产生的原因是Fe2+被O2氧化,建议演示实验时铁钉与CuSO4溶液的反应装置应该密闭。笔者改进了该实验,发现了更多的探究点,于是设计成一堂高三实验探究课,以进一步发展学生的高阶思维。
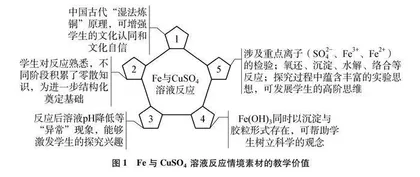
1 情境素材的教学价值
基于课标、学情及探究实验过程,笔者梳理了Fe与CuSO4溶液反应蕴含的教学价值,如图1所示。
Fe与CuSO4溶液的反应涵盖了一系列科学探究要素:提出问题(铁钉与硫酸铜溶液反应后为什么pH下降)→作出假设[Fe3+水解生成Fe(OH)3]→设计实验[检验Fe(OH)3]→依据一系列现象论证观点、评估和改进观点等。经历80分钟的探究过程,可使这个真实的情境素材最大限度地发挥其功能价值,促使学生的核心知识、认识思路和核心观念进一步系统化、结构化,促进科学思维的发展。
2 资料卡片的呈现方式
在Fe与CuSO4溶液反应实验现象的分析过程中,要用到相应的支撑数据或事实性知识。高三复习阶段,若还像新授课或一轮复习课那样在需要的环节呈现所用信息,则脚手架太过明显,反而会限制学生的思维。本节课模拟高考探究实验题中“资料”的呈现方式,将可能用到的信息集中给出,让学生根据解决问题的需要,适时选取合适的数据或事实。相当于给学生提供一个“工具箱”,至于要用到什么工具,什么时候使用,均由学生自行决定。这样,既给了学生自由度,同时也带来挑战,有利于分析、综合、评价、创新等高阶思维的发展。表1、2是本节课的“资料卡片”。
K4[Fe(CN)6]与Fe3+产生蓝色沉淀、与Cu2+产生红棕色沉淀。
3 教学目标及流程
教学目标:
(1) 通过实验探究铁钉与硫酸铜溶液反应后pH降低的原因,建立从热力学和动力学两个角度研究化学反应的视角,纠正对盐类水解程度的偏差认识,发展系统思维、批判思维,提升宏微结合、变化平衡等学科核心素养。
(2) 在Fe3+水解产物Fe(OH)3的检验过程中,发展对“分散系”概念的科学认识,强化识别和排除干扰因素的能力,反复将证据与结论进行逻辑关联,提升证据推理学科核心素养。
(3) 结合具体实验和试题对探究过程建立分析解释“异常”现象的思维模型,促使核心知识、认识思路与核心观念进一步结构化,全面提升思维品质。
探究实验教学流程如图2所示。
4 课堂实录
4.1 发现异常
[驱动性任务]预测铁钉与CuSO4溶液反应过程中的实验现象、溶液pH的变化,并说明依据。
课堂上教学活动过程沿着图3所示的顺序展开。
在之前的学习中,学生已经建构了“物质性质类”和“反应规律类”探究试题的问题解决思维模型,因此在教师提供证据(溶液的pH从4.19降到2.83)之前,有个别学生想到Fe2+可能被O2氧化,但随即被同伴否定,认为Fe、 Cu存在的情况下,Fe3+会被还原为Fe2+。教师提供证据后,新的质疑再次产生:盐类水解程度很弱,Fe3+水解产生的H+能够弥补Fe、 O2反应消耗的H+且还能“绰绰有余”吗?
经过多轮次思维碰撞与简单计算,学生形成了科学的观点:Fe、 Cu与Fe3+的反应是自发反应,但是由于反应速率较慢,故可以在相当长的时间内大量共存;水解程度不是一成不变的,溶液越稀,水解程度越大,pH为2.83时,Fe3+基本水解完全。
注:Fe3+在水中以[Fe(H2O)6]3+形式存在,水解可生成[Fe(H2O)5OH]2+、 [Fe(H2O)4(OH)2]+等,水解后还可能发生缔合作用产生双聚体[3]。为适应高中生的认知水平,水解产物一律用Fe(OH)3表示,后文也将水解产物统称为Fe(OH)3。
4.2 设计方案
[驱动性任务]设计实验证实反应体系中存在Fe(OH)3,用流程图呈现实验方案,方框内为实验对象,箭头上标明试剂和操作。
此环节让学生独立设计并将方法、思路以流程图的形式进行显性化表达,促使其对实验过程产生身临其境的“画面感”,尽可能全面地考虑细节问题,避免思维碎片化。教师巡视过程中对学生的方案做出评价,并指定一位中等程度的学生上讲台板书其方案,随后同伴点评,板书的学生认可后作改进,最终形成如图4的方案(两次过滤后的滤液和滤渣用数字1和2区分)。
学生首先想到Fe(OH)3为沉淀,应该与反应生成的Cu一起存在于红色固体1中,加入H2SO4将其溶解,过滤掉Cu(红色固体2)后,向滤液2中加入KSCN{依据资料卡片还可以加入K4[Fe(CN)6]、 Na2S}检验Fe3+;但是开始并未想到沉淀会吸附Fe3+干扰后续检验,经过互动、补充,确定红色固体1要进行“洗涤”。有几位思维灵活的学生立即想到Fe(OH)3具有胶体性质,于是推测滤液1中可能也有Fe(OH)3,便设计了用激光笔照射滤液1以检验是否产生“光亮的通路”。
4.3 分析解释
科学思维是化学探究实验的灵魂和聚焦点。二轮复习的课时有限,图4实验方案并未让学生动手实施,由教师提前在实验室完成并拍成视频和照片,课堂上作为证据呈现,让学生将证据与结论进行逻辑关联。
当然,规范操作是实验成功的保证,基础实验操作亦不可忽视。例如,学生对如何过滤比较熟悉,但对如何洗涤沉淀却颇感陌生。于是,教师播放洗涤红色固体1的实验视频,强调“淋洗、浸没”等关键点,帮助学生内化基本技能,学生表现兴致盎然。
此环节的重点是发展学生的批判性思维。实验现象与结论进行关联的过程中,学生需作深入思考:现有证据是否足够充分支持这个观点?现有证据还有哪些其他解释?课堂上的独立思考、敏锐发现、大胆猜想和周密论证等此起彼伏、精彩不断。
教学片断一:
[师]怎样证明红色固体1已洗涤干净?
[生A]取最后一次洗涤液检验是否含Fe3+。
[生B]我认为不能马上检验Fe3+,因为红色固体中含有Fe(OH)3,洗涤过程中可“溶解”出Fe3+。
[师追问]如何排除干扰?
[生C]可以另取纯净的Fe(OH)3固体于试管中,加水溶解,滴加KSCN溶液看是否变红。
[生D]也可以依据Fe(OH)3的Ksp计算一下溶解出的Fe3+是否可以使KSCN溶液变红。
[师]两位同学从定性、定量两个角度给出了很好的建议。那么,检验其他离子能证明沉淀中吸附的Fe3+已洗净吗?
[生E]加BaCl2检验SO2-4,若没有SO2-4,则原体系中其他离子也都已洗净。
[师追问]为什么?
[生E]因为这是CuSO4溶液,部分变成了FeSO4,溶液中SO2-4浓度应该最大。浓度最大的离子都没了,浓度小的就更甭提了。
学生纷纷点头,教师也为生E的创新思维点赞!
教师继续呈现证据:取三份滤液2,分别加入KSCN、 K4[Fe(CN)6]、 Na2S溶液,依次出现溶液变红、生成蓝色沉淀、有气泡且出现黄色浑浊的现象,均证实了固体中存在Fe(OH)3。学生逐一写出相关反应的化学(离子)方程式。
[生C质疑]加入Na2S产生黄色沉淀不能证明溶液中存在Fe3+,空气中的O2也可能将S2-氧化。
[师追问]那如何排除干扰?
[生F]可以做一个对比实验,向等体积蒸馏水中滴加同样多的Na2S溶液,看是否产生相同的现象。
[师]思维缜密,系统考虑了反应体系中可能存在的微粒,特别棒!
教学片断二:
[师]反应后滤液1产生丁达尔效应(见图5),由此你可以得出什么结论?
[生F]滤液1中有Fe(OH)3胶体。
[师讲解]Fe3+水解生成Fe(OH)3分子,多个Fe(OH)3分子聚集“长大”,当聚集体直径达到1~100nm范围内,形成Fe(OH)3胶体;沉淀则是聚集体进一步“长大”导致的结果。可见,同一种物质在不同的条件下可以分散成溶液、胶体和浊液。
[生G]我认为Cu(OH)2也可能形成胶体,所以有丁达尔效应不一定能证明滤液中有Fe(OH)3。
[生H]那就排除Cu2+的干扰,向滤液1中加入Na2S溶液,Cu2+会生成CuS黑色沉淀。
[生I]CuS沉淀过程中会不会也有长不到沉淀尺度范围的胶体粒子呢?
[生J]而且Fe3+也可与S2-发生氧化还原反应。
全班陷入沉默、思考中……
见无人发言,教师提供加入铁钉前用激光笔照射CuSO4溶液的照片(见图6),没有丁达尔效应。
[生G]真是大道至简呀,我怎么就没有想到呢!
[师]加入铁钉前后对比,可以说明问题了吗?
[生J]可以。加入铁钉之前,Cu2+浓度大,水解产生的Cu(OH)2浓度也大,此时尚且没有丁达尔效应。反应后Cu2+浓度降低,水解产生的Cu(OH)2浓度也降低,更不可能产生丁达尔效应。所以,反应后丁达尔效应一定是Fe(OH)3胶体所致。
[生K]反应后溶液pH=2.83,根据Ksp数据计算,此时Cu2+、 Fe2+还未开始沉淀,Fe3+则已几乎沉淀完全,所以丁达尔效应确实能证明含有Fe(OH)3胶体。
4.4 又见异常
Fe(OH)3由Fe3+水解产生,该反应可逆,故学生推测滤液1中有“游离”的Fe3+存在,加入KSCN溶液理应变红。教师播放滤液1中加入KSCN溶液的视频,溶液立即变红,但红色很快褪去,产生了白色沉淀。请学生利用化学用语解释该“异常”现象。
结合已有知识与资料卡片,生L上台板书写出两个反应的方程式:
(1) Fe3++3SCN-Fe(SCN)3
(2) 2Cu2++4SCN-2CuSCN↓+(SCN)2
两个反应解释了溶液变红和生成白色沉淀。
[生M举手]我发现刚滴入KSCN溶液立即变红,说明反应(1)速率快;随着白色沉淀生成,红色褪去,说明反应(2)限度大。
[师]思维敏捷,考虑全面!不仅解释了实验结果,还解释了实验过程。一般来说,氧化还原反应的活化能较大,反应速率较慢;而复分解反应活化能较小,反应速率较快。
本环节用实验视频代替照片,目的就是让学生不能只关注结果,还要关注反应过程,稳固从热力学和动力学研究反应的两个角度,再次呼应环节1中Fe、 Cu与Fe3+既能相互反应(热力学角度),又可以共存的事实(动力学角度)。
4.5 系统梳理
教师呈现对比实验:将等质量铁粉加入等浓度、等体积的CuSO4溶液,反复振荡使其充分反应,一段时间后溶液pH升高。取等量的三份上层清液于试管中,分别加入K3[Fe(CN)6]、 K4[Fe(CN)6]和KSCN溶液,现象如图7所示。