基于信息处理与模型建构的课堂教学设计和实践
作者: 叶依丛
摘要:“化学反应的调控”是根据化学反应原理指导实践的重要内容,揭示了知识的实践价值。分析并归纳从理论学习到科学实践层面的主要难点,以“合成氨工业条件选择”为例,通过处理合成塔中真实物料数据、合成氨反应机理示意图、铁催化下合成氨反应历程-势能图等一系列真实信息,引导学生从反应限度-速率-技术-效益等综合角度构建真实情境下化工条件的选择与优化的思维模型。
关键词: 信息处理; 模型建构; 合成氨; 调控反应
文章编号: 1005-6629(2022)03-0041-07
中图分类号: G633.8
文献标识码: B
1 提出问题
《普通高中化学课程标准(2017年版2020年修订)》在“化学反应原理”模块主题2“化学反应的方向、限度和速率”中,新增了化学反应的调控内容: 认识化学反应速率和化学平衡的综合调控在生产、生活和科学研究中的重要作用。知道催化剂可以改变反应历程,对调控化学反应速率具有重要意义[1]。它指明了学习反应原理相关理论的实践价值和社会价值,帮助学生建构综合认识化学反应的思路,寻找最优的反应条件调控实际生产中的反应。
但是,当学生面临真实情境下工业生产条件的选择和优化时,往往存在较大的困难。通过与学生的沟通与对话后发现,这部分内容在“输入”和“输出”的转化过程中,普遍存在两个难点:
第一,学习的过程采用封闭、静态的平衡体系为研究对象得到相关结论,但真实的工业生产过程,却是一个开放、动态的体系。故不能利用“理想状态”的结论简单地推演并解释真实反应过程。
第二,学习过程一般是从孤立的角度调控反应速率或者反应限度,而实际工业生产中需要综合考虑反应速率和反应限度因素,且某一条件的改变对反应速率和反应限度的影响往往是矛盾的,复杂问题背景下难以抽提出解决问题的关键要素。
要攻克上述难点,必须厘清以下问题: 一是“真实的开放体系”与“理想的封闭体系”两者的区别是什么?二是如何建立综合角度调控反应?三是催化剂为什么对调控反应有重要意义?
2 主题价值分析
比较不同版本的教材,针对“化学反应的调控”内容,人教版和鲁科版教材都选择“合成氨反应条件的选择”为主题展开讨论,这与合成氨反应本身具有的独特 的学科价值与社会价值密切相关。
首先,合成氨工业相对成熟,便于提供合成氨塔内各组分浓度的真实物料数据。引导学生关联相关知识、分析和计算数据,有效打破思维定势,建立“开放体系”的思考模型,为合成氨工业条件的选择提供思考的起点。
其次,合成氨反应是一个放热反应,温度升高有利于加快反应速率,但不利于平衡正向移动。选择最优温度的过程,能有效帮助学生建立“单位时间转化率”的概念;压强增大有利于促进平衡正向进行,但对设备提出了很高的要求,因此选择最佳压强的过程,将科学理论与工程技术相结合,有助于形成速率—限度—技术—效益等多角度考虑工业问题的思维。
第三,合成氨反应蕴含丰富的关于催化剂改变反应历程的学科本体素材[2],经过适当加工后能有效引导学生从微观角度认识基元反应、催化剂与活化能的关系,有助于学生在复杂问题中抽提关键要素建立逻辑关系,形成有序调控反应的思维模型。
第四,合成氨反应融合了科学发展史,系统地梳理人类探索合成氨反应条件优化的发展脉络,将调控化学反应的认识思路外显化、认识角度结构化,有助于学生形成综合调控化学反应的思维模型。
3 学习目标确立
(1) 通过理论分析合成氨反应条件,运用反应方向、限度和速率等理论知识调控生活、生产中的化学反应,形成稳定的认识思路。
(2) 通过对合成氨塔中各组分浓度的定性、定量分析,构建分析化工生产中“开放体系”的思维模型。
(3) 通过认识催化剂参与下合成氨的微观反应历程,知道基元反应活化能对反应速率的影响,从“提高反应决速步骤速率”的角度优化反应条件。
(4) 通过解读合成氨反应的科学发展史,了解科学家的科学态度和社会责任感,总结提炼“多角度分析化学反应,选择和优化化工生产条件”的思路,体会化学反应原理的社会价值和应用价值。
4 教学设计构思
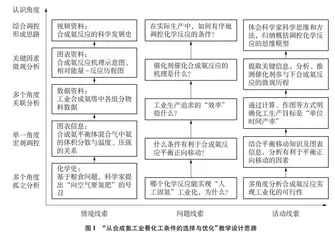
围绕“如何调控反应”以及“为什么这么调控”两个核心问题,为学生提供一系列真实的数据、图表信息。学生在分析和处理信息的过程中,深度认识化学反应的方向和限度、工业生产的效率、催化剂改变反应历程的微观原理等问题;学生认识和调控反应的视角由发散到聚焦、由单一到综合、由宏观到微观,从而形成有序调控反应的思维模型。具体教学设计思路如图1所示。
5 课堂实践实录
5.1 创设情境,引入课题——构建化工生产主反应选择思路
[教师]19世纪,随着第二次工业革命的到来,世界人口剧增,人类面临粮食不足的问题,各国都迫切要求建立规模巨大的生产氮化合物的工业。科学家克鲁克斯创造性地提出“向空气要氮肥”的号召。
[设问]为什么要“向空气要氮肥”?
[学生]思考、回顾。空气中氮含量高,主要以不被植物吸收的N2存在,需要将N2转化为能被植物吸收利用的含氮微粒。
[追问]回顾学过的人工固氮反应,哪个反应可以实现工业化生产?说明原因。
[学生]N2+3H22NH3可以实现工业化生产。原因如下: (1)NH3可以进一步转化为NH+4、 NO-3被植物吸收和利用;(2)该反应原料来源丰富;(3)合成氨反应ΔH<0,ΔS<0,低温下反应能自发进行;(4)该反应在常温下反应限度较大。
[教师]合成氨反应被誉为“20世纪科学领域最辉煌的成就之一”,它成功解决了粮食问题。如何调控反应条件使它满足工业化生产的要求呢?我们一起学习“从合成氨工业看化工条件的选择和优化”。
设计意图: 追溯“合成氨工业”产生的历史背景,使学生切实感受到科学家们面对社会需求时所展现的科学态度和社会责任感,充分体现化学对人类社会进程的重要推动作用。引导学生从解决粮食问题——制造肥料出发,按照“需要合成什么→需要用什么原料→选择什么反应→该反应热力学是否可行→是否能够实现工业化生产”的思路展开思考,初步构建化工生产中主反应选择的思路。
5.2 运用旧知,理论分析——从平衡角度选择合成氨反应条件
[ppt]N2(g)+3H2(g)2NH3(g),ΔH=-92.2kJ·mol-1。
[设问]结合图表数据(见图2),描述平衡状态时,氨的体积分数与反应的温度、压强有什么关系?
[学生]读图并回答: 在平衡混合物中,压强一定时,温度升高,氨的体积分数减小;温度一定时,压强增大,氨的体积分数升高。
[设问]请用平衡移动原理判断并解释什么条件有利于合成氨反应正向进行?
[学生]高压、低温条件。合成氨反应是一个熵减的放热反应,压强增大和温度降低均有利于平衡正向移动。
[教师]1MPa=1×106Pa,30MPa相当于30N的力(约300kg的重量)作用于1cm2的面积上所产生的压强。考虑设备的承受能力,工业上往往选择10~30MPa的压强。
[设问]在30MPa压强下,选择低温作为工业生产条件是否合适?
[学生]不合适,温度降低虽然有利于平衡正向移动,但是温度降低,反应速率减慢,导致生产效率低。
[教师]温度在调节速率和平衡的时候出现矛盾,选择哪个温度最合适呢?需要进一步讨论,工业生产追求的主要目标是什么?
设计意图: 先从单一的热力学角度(即化学平衡角度)对合成氨反应条件进行选择,有利于学生思考相关问题时思维的有序性。但理论运用于实际时会出现偏差需要修正,并引出关键问题: 化工生产中追求的主要目的是什么?为后文动力学分析(即速率角度)做好铺垫,由浅入深、由单一到综合地讨论合成氨反应条件的选择与优化。
5.3 数形结合,突破难点——构建动态开放体系的认识模型
[教师]不妨走进真实的合成氨工厂看一看。ppt中展示的是某日产600t氨气的合成氨工厂的化工设计图的物料平衡数据(如表1所示),请关注合成氨塔气体进口和气体出口各组分的气体体积分数。
[教师]为了方便计算,将合成氨塔进气口和出气口中N2、 H2、 NH3的气体体积分数折算成以物质的量浓度为单位,并折算相同的条件下该反应达到平衡时,N2、H2和NH3的平衡浓度数据如表2所示。
[设问]在合成氨塔中,合成氨反应达到平衡了吗?判断依据是什么?
[学生]用平衡浓度计算得该反应在439K温度下Kc=c2(NH3)c(N2)·c3(H2)=2.5120.747×2.103=0.910,再计算合成塔出塔口各组分的浓度商
Qc=c2(NH3)c(N2)·c3(H2)=0.99721.03×2.993=0.0360,Qc<Kc,反应没有达到平衡。
[教师]请作图表示从投料到平衡,总反应的速率—时间变化曲线,根据图像和数据解释为什么合成氨塔中不等反应达到平衡?
[学生]作图(如图3中曲线)。从图中可以看出,随着反应的进行,总反应速率不断减小最后趋近于0,速率过低不利于工业生产效率。
[教师]请在图3的基础上,画出其他条件均相同、合成氨塔中从进料到出塔单个回合的速率—时间曲线,并分别说明两条曲线与坐标轴形成的面积所代表的物理意义。
[学生]作图(如图3所示)。深色图形面积代表合成氨塔中从进料到出塔单次合成氨气的浓度,浅色图形面积代表相同条件下合成氨反应达平衡时氨气的浓度。
[教师]虽然一个回合的氨气产量比不上平衡产量,但可以再来一个回合,再来一个回合,如此不断重复,形成如图4所示的速率—时间曲线。
[设问]比较单位时间内,上述速率—时间图中两种曲线围成的面积的大小。并解释工业上不等到反应达平衡,而采用不断投料的方式进行生产的优势是什么?工业生产追求的目标是什么?
[学生]优势在于让反应持续在反应物浓度比较大、速率比较高的状态下发生,增大产物在时间上进行叠加之后的总量。
[学生]工业追求的是单位时间的产量,所以除了考虑反应限度,还要考虑反应速率。
设计意图: 为学生提供合成氨塔中真实的物料数据,引导学生从定性与定量结合的角度收集证据。通过定性分析、定量计算以及数形结合分析等方法,打破惯有的封闭体系反应平衡的定势思维,重塑工业生产中开放体系、循环投料的思维模型。该模型的建立有助于学生抓住本质,更深刻地理解工业生产调控的关键着力点。形成模型的过程充分建立了证据—结论之间的联系,培养学生的证据推理能力。
5.4 信息助力,微观探析——理解催化剂作用下的反应历程
[提问]控制哪些反应条件可以提高合成氨反应的反应速率?
[学生]升高温度、增大压强、提高反应物浓度、加入催化剂……
[教师]催化剂能加快化学反应速率的本质原因是什么?请在能量—反应历程图中画出催化剂参与下合成氨反应过程中的能量变化。
[学生]作图(如图5所示)。
[追问]加入催化剂之后能量图出现两个峰代表什么含义?
[学生]代表催化剂先作为反应物参与反应,又作为产物生成。
[教师]这是合成氨在铁触媒催化作用下,通过计算机模拟生成的能量—反应历程图[4](如图6所示)。
[教师]请用自己的语言描述,加入催化剂后,该反应的能量—反应历程图像有什么变化?
[学生](1)加入催化剂之后,活化能大大降低;(2)加入催化剂之后,产生了几个小峰,说明发生了几个反应。