“青铜器”教学资源的开发与利用
作者: 吴晗清 李思凡
摘要:青铜器是我国古代文明的瑰宝。从化学角度可以将青铜器相关素材划分为五个方面,即青铜器的化学成分、冶炼与铸造、腐蚀与污染、保护与修复、鉴别与仿制。青铜器资源在化学教学中具有重要的意义和价值,不仅可以丰富学生的知识领域、提升学生的实验能力,而且可以培养学生科学的思想方法,增强中华民族的文化自信。
关键词: 青铜器; 化学史; 教学资源; 文化自信
文章编号: 1005-6629(2022)03-0084-06
中图分类号: G633.8
文献标识码: B
我国是古老的文明国家之一,青铜器堪称文化瑰宝。2021年三星堆遗址的再度发掘,独树一帜的青铜造型又一次惊艳了世界。我们从化学的视角去解读青铜器,可以极大地提升学生的兴趣。不仅能够更好地掌握相关学科知识,了解化学工艺过程与方法,更重要的是增强中华民族的文化自信。
1 青铜器的历史变革与器物造型
青铜器历史悠久,一直以来都是考古学家们研究的热点。在青铜器的起源、成分、冶炼和铸造、修复与保护等多方面,取得了丰硕的研究成果。从某种意义上讲,青铜器的历史就是古代的化学史。当前基础教育越来越重视课程的开放性和综合性,提倡不同学科的交叉渗透和跨学科课程资源的整合。然而化学教学实践中,很少关注青铜器这一重要的历史资源。因此,我们有必要对此进行全面深入的分析。
1.1 青铜器的历史变革
在新石器时代与青铜器时代之间,有一个铜石并用的时代,此时的“铜”指纯铜。到了夏代,青铜器的制造工艺逐渐成熟,也是青铜器文明的发端。商代进入鼎盛时期,这时人们已经掌握了青铜含锡、铅的比例,在世界冶金史上有着重要的意义。青铜器的发展延续了一千六百多年,直到战国末期铁器的出现,才逐步被取代。具体来说,根据青铜器的化学成分和铸造工艺,可将青铜时代划分为四个时期[1]: 一是殷末周初,这一时期的铜含量差别微小;二是西周晚期至春秋中叶,此时的青铜冶炼技术逐渐向质薄、形巧过渡;三是工商业发达时期,新兴封建制度形成,这一时期青铜器文物的花纹纤细,铜含量减少而铅含量显著增加,该成分的波动源自形制波动;最后一个时期是青铜器逐步让位于铁器,种类繁多的铁器逐渐取代了青铜器在日常生产生活中的作用。
1.2 青铜器的器型
我国古代青铜器的使用十分广泛,人们将其应用于日常的生产生活中,为人类提供了许多便利。青铜器主要有三大器类: 用器、兵器和乐器。用器,主要是食器、酒器及水器。食器有,“鼎”“鬲l씓甗yǎn”“簋guǐ”“簠fǔ”“盨xǔ”“敦du씓豆”等。其中“鼎”是用来煮肉和盛肉类的用具,被视为传国重器、国家和权力的象征。酒器和水器有“爵ju锓觚gū”“斝jiǎ”“觯zh씓觥gōng”“角ju锓樽zūn”“卣yǒu”“盉h锓彝y픓勺”“罍léi”“壶”“盘”“匜y픓瓿bù”“盂yú”“鑑jiàn”“缶fǒu”等。飞觥走斝、觥筹交错、折冲樽俎、瓶罄罍耻等成语都与这些器物有关。
青铜兵器是行军打仗必备的重要工具,由于古代战争频繁,青铜兵器的种类十分丰富,如“钺yu蔓戈”“矛”“戟jǐ”“剑”“刀”“镞zú”“弩机”“胄zhòu甲”等,数量也极多。许多成语如不避斧钺、化干戈为玉帛、折戟沉沙、强弩之末等,都与兵器有关。青铜乐器是我国古代夏商周时期音乐文明中最典型的代表,其种类繁多,构建起了一个完整的音乐体系。乐器有“铎”“鑃diào”“镈bó”“铙náo”“钟”“钲zhēng”“铃”“鼓”等。如铎用于宣布政教法令,《论语》载“天下之无道也久矣,天将以夫子为木铎”。在中国国家博物馆,我们都可以一睹它们的风采。每类器物规格不一、造型各异,彰显了我国古代青铜器冶炼技术的高超,以及中华礼乐文明的发达。
2 基于化学视角的青铜器解析
2.1 青铜器的化学成分
目前出土的青铜文物多以铜锡合金、铜锡铅合金为主,其中也含少量其他金属。最早详尽准确的合金配比技术,应为《周礼·考工记》中记载的“金有六齐: 六分其金而锡居一,谓之钟鼎之齐;五分其金而锡居一,谓之斧斤之齐;四分其金而锡居一,谓之戈戟之齐;参分其金而锡居一,谓之大刃之齐;五分其金而锡居二,谓之削杀矢之齐;金锡半,谓之鉴燧之齐”[2]。然而研究者对“六分其金”有不同看法,部分认为“金”指青铜,部分则认为是纯铜。经过后人不断地研究与比对,最终确认此处“金”指的是纯铜。即铜占六份,锡占一份[3,4]。
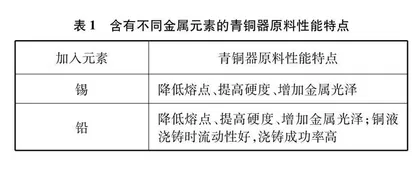
随着研究的深入,人们发现了不同朝代青铜器成分的规律。其中夏代晚期青铜器合金主要为锡青铜、铅锡青铜和纯铜;商代和西周时期为锡青铜和铅锡青铜两类,且以后者居多;春秋战国青铜器中则还含有铁和锌等元素。随着铸造技术的发展和工艺的要求,铅锡青铜等更能满足复杂造型的需要。青铜作为一种合金材料,与其他合金一样有着良好的性能。与纯铜相比,青铜硬度高,熔点较低,具有金属光泽和抗腐蚀性。向铜中加入其他金属元素对改变其性能有着不同的作用,具体如表1所示。
青铜器中所含的不同金属元素也对其鉴别有着重要的作用,考古学上经常使用铅同位素标记的方法对青铜器的产地、年代进行研究。如地球化学家在研究甘肃黑河流域商代早期的青铜冶炼遗址时,发现使用的伟晶岩矿石中含有锂云母、锂辉石、铯榴石、锆石、细晶石、绿柱石(含铍)和铌钽铁矿,因而推断商代的青铜器已经开始使用锂、铍、铯、锆、铌、钽等稀有金属来改良器具的外观和性能[5]。在初中“合金”、高中必修“金属材料”的教学中,可以引入这一教学资源,让学生了解合金工艺的传承与发展,同时掌握加入不同的金属元素,合金性能的变化及原因,从而迁移至其他情境之中。同位素标记法是现今最为常见的一种探寻物质变化的重要手段,广泛应用于青铜器的鉴别。如由于不同地域铅同位素含量有差异,因而可以判断青铜器的铸造地。这些素材让学生更加直观地感受到化学无处不在。
2.2 青铜器的冶炼与铸造
我国古代青铜器制造工艺的全过程可以概括为三个主要程序: 勘探原料、冶炼精铜、浇铸成器。首先,勘探原料。金属在地球上主要以矿石的形式存在,多为金属氧化物或者盐类。《管子·地数篇》中总结了勘采规律,“上有丹砂者,下有黄金;上有慈石者,下有铜金;上有陵石者,下有铅锡赤铜;上有赭者,下有铁”[6]。经学者们深入研究,认为目前最早用于冶铜的矿石为孔雀石,其成分可用Cu2(OH)2CO3来表示。
其次,冶炼精铜。古代冶炼金属时主要使用木炭还原,碳与氧气反应提供能量,同时伴随生成一氧化碳为后续还原铜做准备。孔雀石加热分解生成氧化铜、二氧化碳和水。在高温环境下氧化铜会被一氧化碳还原成单质铜。战国初期,人们利用皮囊这一最原始的鼓风设备,使得反应炉内的温度急剧上升,因而在炼铜反应中由一氧化碳还原为主转至以碳还原为主。冶铜是制造青铜器中非常重要的一步,青铜时代对冶炼进程的把握全凭观察火焰颜色。《周礼·考工记》载“凡铸金之状,金与锡黑浊之气竭,黄白次之;黄白之气竭,青白次之;青白之气竭,青气次之,然后可铸也”[7]。铜矿由于经历了蒸发、分解、化合等过程,分别出现不同颜色的火焰。黑色火焰源于铜矿中有机物的燃烧,黄白色源于氧化物、硫化物等杂质,青白色是由于部分铜熔化造成的,而青色主要源自高温时比二价铜离子更稳定的一价铜离子[8]。智慧的古人根据经验得出,只有当青色的火焰出现,也就是“炉火纯青”时才可铸器。
最后,浇铸成器。由铜和锡铅制青铜属于物理、化学过程,不同的成分配比炼得不同性质的青铜,然后用于铸造不同类型和不同风格的青铜器。中学阶段在学习金属的冶炼、工业流程等相关内容时,可以引入冶炼和铸造青铜器的素材。让学生通过化学史的情境,激发他们学习化学的兴趣,引领他们用化学专业的视角去阐释古人留下的宝贵财富,进一步深刻掌握相关化学知识与技能,并在此过程中感悟中华文化的博大精深和先人的聪明才智,增强文化自信与学科自信,水到渠成地落实课程思政。
2.3 青铜器的腐蚀与污染
2.3.1 青铜器的腐蚀
青铜器的腐蚀,外观结果主要是生成锈迹。青铜器的铜锈分为两种,即无害锈和有害锈,见表2。无害锈主要以氧化铜等氧化产物为主,还有少量铜盐和硫化物。它们在青铜器表面形成保护膜,防止进一步被腐蚀。主要原因是潮湿环境下,铜与氧气、二氧化碳、硫化物等物质发生反应。有害锈则以粉状锈为代表,它是一种恶性膨胀的铜锈,其质地疏松呈粉状易脱落,文物界称之为“青铜病”,还会“传染”。粉状锈的主要成分是碱式氯化铜,其化学式为CuCl2·3Cu(OH)2。氯离子、溶解氧、潮湿环境是造成粉状锈产生的主要原因。
青铜器腐蚀本质上是金属腐蚀,因受环境影响而发生化学反应或电化学作用引起金属的变质或损坏。金属腐蚀受到多重因素的综合影响,其中自身因素主要是化学成分、元素分布、是否含有杂质以及其热力学稳定性等。环境因素主要包括环境之中是否含有杂质或易于氧化变质的物质、有无缓蚀剂、腐蚀产物的性质和分布等。除此之外温度、湿度、压力、放射性辐照等也是重要因素。研究者们通过电化学测试分析发现,随锡含量增加,锡青铜的耐腐蚀性增强。
青铜器腐蚀问题涉及到化学教学中电化学、金属的腐蚀与防护等问题,可在相关教学中引入青铜器腐蚀的素材。电化学的内容一直是教学的重难点,学生容易出现畏难情绪而有所抵触和懈怠。教师若能结合青铜器这一新颖独特而又有价值的素材,引领学生进行探究,不仅能激发学生的兴趣,还能将复杂而抽象的理论直观化,有助于学生对原理的理解,同时深刻感知化学理论对于实践的重要意义。
2.3.2 青铜器的污染
随着大量青铜器产业的发展,工业制造所产生的污染也难以避免。青铜器的主要成分为铜元素,尽管铜元素是人体所必需的微量元素,但含量超标就会产生毒性作用。铜元素中毒引发疾病,轻则腹泻恶心,重则昏迷甚至死亡。同时吸入铜盐粉尘可能会引起鼻隔膜穿孔,若大量沉积在肺部可能会导致肺癌和肝癌。这部分的资源可以融入化学元素与人体健康的学习,让学生对铜元素等重金属中毒的机理和症状有新的认识,同时辩证地看待每一种物质。
2.4 青铜器的保护与修复
青铜器的保护与修复方法多样,包括物理方法和化学方法。物理方法,如机械法、超声波法。化学方法,有酸碱法去锈、局部封闭法、金属缓蚀剂、电解还原去锈、电化学还原去锈、铜及铜合金的涂装等。化学除锈和保护应在除去有害锈的同时,保存无害锈,使文物的特征颜色不被改变,修旧如旧,保留文物上原有的考古信息。根据青铜器的锈蚀形成的原理,化学除锈主要目的是清除锈层中的氯离子,同时隔绝空气中的氧气和二氧化碳,防止氧化和保持表面干燥。因此主要分为除锈和防护两个环节,应根据实际情况选择合适的处理方法。下文是具有代表性的三种方法[11~14]。
首先是倍半碳酸钠浸泡法。倍半碳酸钠(NaHCO3·Na2CO3·2H2O)溶液是一种弱碱性的缓冲溶液,一般用5%的浸泡液浸泡,由于CO2-3可以使含氯有害锈转化为碱式碳酸铜,而碱式碳酸铜是一种稳定的铜锈,它使铜锈古斑能够长期保存。这种浸泡需要很长时间才能使铜器表面颜色变成绿色,期间要不断地更换溶液,需要大量的药品溶液,而且处理过的青铜器表面由于氧化而发黑。化学反应为Cu2(OH)3Cl+CO2-3CuCO3·Cu(OH)2+OH-+Cl-。其次是氧化银(Ag2O)局部封闭法。用乙醇将氧化银调制成糊状,涂抹在锈蚀的器物上。氧化银在潮湿的条件下遇氯化物,形成氯化银的棕褐色角银膜,从而将含有氯化亚铜的病区封闭起来。反应的方程式为Ag2O+2CuCl2AgCl+Cu2O。它不适合大面积处理,适用于斑点状“粉状锈”局部腐蚀的器物。还有缓蚀保护法。苯并三氮唑(C6H4N2·NH)保护法,1965年开始用于保护青铜器,已被国际上公认为理想方法。苯并三氮唑是一种奶白色的针状结晶,比重很小,其熔点为96~100℃,易溶于醇、丙酮、氯仿等有机溶剂中,在水中溶解度很小。苯并三氮唑能与铜及铜盐形成较为稳定的配合物,在青铜器表面形成一层透明保护膜。反应的方程式为2Cu+O2+4C6H4N2·NH2(C6H4N2·N)2Cu+2H2O。用脱脂溶剂也很难去除掉它,阻止了器物的进一步腐蚀。