基于项目式教学进行模块复习的实践探索
作者: 武衍杰 江合佩 杨伏勇
摘要: 以化学反应原理助力“碳达峰、碳中和”为主题,运用项目式教学进行《化学反应原理》模块的复习。以“什么是碳达峰、碳中和”“为什么提出碳达峰、碳中和”“如何实现碳达峰、碳中和”三个核心问题聚焦《化学反应原理》模块中水溶液、热力学、动力学、电化学等核心知识的迁移应用,彰显化学学科价值。
关键词: 项目式学习; 碳达峰、碳中和; 化学反应原理; 真实情境; 模块复习
文章编号: 10056629(2022)06004008
中图分类号: G633.8
文献标识码: B
复习课教学承载着整合知识、提升能力的价值,但上好复习课一直是一线教师的难题。特别是模块复习课一般以综合性习题讲解为主,这种方式难以激发学生的学习兴趣,学习的主动性难以发挥,也难以自主建构整合知识。项目式学习在实现学科知识、认识思路、学科观念结构化方面具有独特价值[1]。项目式学习倡导学生综合利用所学知识解决陌生、复杂的问题,项目实施过程中学生调用结构化的学科知识和技能、学科思维方式以及学科价值观念解决项目问题,形成能够迁移应用的解决一类问题的思路和模型。本文以项目式教学的形式对高中《化学反应原理》模块的复习进行探索。
1 项目教学主题分析
采用项目式教学进行模块复习的关键是寻找合适的项目主题涵盖模块核心内容。《化学反应原理》模块的核心内容包括水溶液、热力学、动力学、电化学等知识。该模块设置的目的在于引导学生进一步认识化学变化所遵循的基本原理,初步形成关于物质变化的科学观念,了解化学反应中能量转化所遵循的规律,赞赏运用化学反应原理对科学技术和人类文明所起的重要作用[2]。因此复习重点在于提升学生从原理层面对化学反应系统的、本质的认识,体现化学学科的社会价值。提出以化学反应原理助力“碳达峰、碳中和”为主题进行模块复习具有如下优势:
(1) “碳达峰、碳中和”是一场广泛而深刻的经济社会系统性变革,需要共同关注。特别是化学技术驱动“碳达峰、碳中和”是化学人必须思考的问题,这一主题可以体现化学学科价值,激发学生化学学习的动力。
(2) 从化学视角对“碳达峰、碳中和”这一素材解构可聚焦《化学反应原理》模块的核心内容。如实现“碳达峰、碳中和”的化学路径包括对CO2进行溶剂吸收、转化利用等,而这些技术手段与热力学、动力学、电化学等内容密切相关,可满足整合模块知识的要求。
(3) 该项目主题可在学生的深度参与中潜移默化地提升科学态度与社会责任感。如教学中针对“为什么提出碳达峰、碳中和”并不是直接呈现CO2过量排放带来的系列问题,而是以具体探究“珊瑚礁的形成、消失与保护”任务为切入点,让学生结合水溶液相关知识通过证据推理认同“碳达峰、碳中和”提出的意义。
2 项目教学目标
结合模块复习要求,制定具体目标:
(1) 通过深度参与化学反应原理助力“碳达峰、碳中和”项目,体会化学学科在解决全球环境问题中的重要价值,增强化学学习兴趣和社会责任感。
(2) 通过为什么提出“碳达峰、碳中和”任务,结合“水溶液”相关知识探究“珊瑚礁形成、消失、保护”问题,形成系统化、有序化的水溶液体系分析的一般思路。
(3) 通过如何实现“碳达峰、碳中和”任务,结合热力学、动力学等相关知识探析化学溶剂吸收法、化学转化利用法(非电化学转化),建构工业生产条件选择问题的一般思路。
(4) 结合热力学、动力学、电化学相关知识探析化学转化利用法(电化学转化),巩固并优化电化学认识模型,形成真实情境下分析物质转化问题的思维模型。
3 项目任务及教学流程
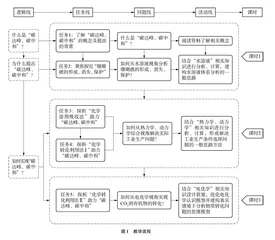
遵循“是什么、为什么、怎么办”的问题解决逻辑,将整个项目拆解为五个核心任务,分3个课时完成,各课时既具综合性又有侧重点,合力解决“碳达峰、碳中和”问题。如课时3重点指向“电化学”内容复习,但在项目推进过程中又涉及热力学计算、动力学分析、电解质溶液知识等。整个项目在一个真实而有意义的主题下,打通了单元与单元间的界限,实现了模块内综合。教学流程如图1所示。
4 项目实施及学生学习结果
4.1 什么是碳达峰、碳中和——了解碳达峰、碳中和的概念及提出背景
[情境导入]结合视频或新闻引出“碳达峰、碳中和”项目主题(见图2),提出问题“关于碳达峰、碳中和”你想了解什么?”,确定项目框架。
[学生汇报]遵循陌生问题解决逻辑,主要了解“什么是‘碳达峰、碳中和’”“为什么提出‘碳达峰、碳中和’”“如何实现‘碳达峰、碳中和’”等问题。
[资料支持]提供主题相关资料[3]。
[学生]阅读资料,了解主题背景及相关概念。
[教师过渡]近年来CO2过量排放引发了系列灾难: 极端天气、冰川消融、永久冻土层融化、珊瑚礁死亡等,“碳达峰、碳中和”就是在这样的背景下提出的。可能单纯地说这些问题,大家还不能真正建立两者之间的关联,下面以珊瑚礁死亡为例,体会“碳达峰、碳中和”提出的迫切性。
4.2 为什么提出碳达峰、碳中和——探究珊瑚礁的形成、消失与保护
[教师提问]珊瑚礁是珍贵的海洋资源,可以带来多种利益: 提供食物、支撑旅游、保护海岸等。其形成主要依赖珊瑚虫的钙化作用形成石灰石外壳。海洋中的碳循环路径如图3所示,试用化学用语解释珊瑚礁的形成。
[学生汇报](1)海洋中存在Ca2+和CO2-3可直接生成CaCO3(Ca2++CO2-3CaCO3↓);(2)从图3可知钙化作用生成CaCO3的同时还会生成CO2,存在反应Ca2++2HCO-3CaCO3↓+CO2↑+H2O。
[教师追问]上述两个过程都能生成碳酸钙,以哪一个反应为主呢?已知正常海水pH为8.0~8.3,海水中含碳元素微粒分布如图4所示,判断哪一个为主反应,并尝试从平衡移动的角度解释该反应为什么能够发生?
[学生讨论汇报]海水中可能存在的平衡关系如表1所示。由图4知,正常海水中HCO-3含量最多,因此钙化作用主要与HCO-3相关。从反应结果来看,要形成碳酸钙,必有Ca2++CO2-3CaCO3(s)平衡,该过程会造成溶液中CO2-3浓度减小,进而使HCO-3 CO2-3+H+平衡向右移动,造成溶液中H+浓度增大,从而发生H++HCO-3CO2↑+H2O过程(也有学生认为H+浓度增大使H2CO3HCO-3+H+平衡逆向移动)。总的来看是微观的平衡移动引发宏观反应,表现为珊瑚礁形成,因此总的主反应为Ca2++2HCO-3CaCO3↓+CO2↑+H2O。
[初步建构分析思路]海水为复杂水溶液体系,同学们分析了体系中存在的微粒及微粒间作用,根据信息找到各类平衡的主次关系,并根据宏观反应结果(沉淀和气体)逆推了微观的平衡移动过程,其实这正是分析复杂水溶液体系的一般思路: 物质(微粒)→微粒间相互作用→微粒种类或数量的变化→宏观现象,推理路径之间相互印证,既能顺向推理也能逆向推理。
[教师追问]反应Ca2++2HCO-3CaCO3↓+CO2↑+H2O的发生除了从定性角度理解,还能否从定量角度说明呢?[H2CO3 Ka1=10-6.51, Ka2=10-10.33; Ksp(CaCO3)=2.5×10-9]
[学生汇报]定量角度需计算反应的平衡常数K,根据已知数据可知K=Ka2/(Ksp×Ka1)=4×104.18,可见反应的平衡常数很大(浓度允许范围内),说明Ca2+、 HCO-3在混合体系中很容易发生反应。
[师生归纳,优化认识思路]如图5所示,注意微粒间作用的主次关系,另外分析微粒种类和数量的变化既可以有定性视角也可以有定量视角。
[认识思路运用]通过分析可知,珊瑚礁的形成主要与Ca2+、 HCO-3有关,请同学们利用上述认识思路分析为什么CO2排放量增多时,珊瑚礁会破坏?
[学生讨论汇报1]首先分析体系中的微粒及存在的相互作用(同表1),当有过量CO2介入体系,平衡
被打破。由于CO2含量增加,H2CO3两步电离平衡向右移动,造成CO2-3和H+浓度升高,会对CaCO3(s)
Ca2++CO2-3这一平衡产生两个不同的作用结果,CO2-3浓度升高使平衡逆向移动,利于珊瑚礁的形成,
但H+浓度若大幅升高,又会结合CO2-3使平衡正向移动,珊瑚礁溶解。
[学生讨论汇报2]通过主次关系可知,H2CO3的第一步电离肯定大于第二步电离,所以H+浓度变化肯定远大于CO2-3浓度变化,因此少量增加CO2可能利于钙化作用,但CO2含量若大幅度增加就会使珊瑚礁溶解,即CaCO3+CO2+H2O
Ca2++2HCO-3。
[教师总结并提问]我们利用水溶液分析思路证明了珊瑚礁的生存与大气CO2含量密切相关,据相关预测,海水的pH本世纪末预计达到7.8,届时珊瑚礁有可能消失[4]。保护珊瑚礁迫在眉睫,“碳达峰、碳中和”势在必行!谈谈我们应如何保护珊瑚礁?
[学生汇报]保护珊瑚礁的关键是减少CO2的排放量: 一方面是从源头上停止或减少CO2的排放,如节能减排或扩大利用无碳、低碳新能源等;另一方面是从终端入手,对排放的CO2进行捕集、封存或再利用。
4.3 如何实现碳达峰、碳中和——探析化学溶剂吸收法、化学转化利用法(非电化学转化)
[教师过渡]上节课大家谈了助力“碳达峰、碳中和”的措施。但是从现实考虑,我国短时间内很难改变能源结构,而植树造林对于CO2含量的改变也很难立竿见影。CO2的捕捉或再利用是可以考虑的办法,基于CO2性质,应如何捕捉CO2?
[学生汇报]CO2是酸性氧化物,可利用碱性溶剂吸收。
[教师提问]目前,NH3(l)和(NH4)2CO3(aq)是常用工业捕碳剂,其中(NH4)2CO3(aq)与CO2可发生反应(NH4)2CO3(aq)+H2O(l)+CO2(g)
2NH4HCO3(aq),不同温度下,(NH4)2CO3与CO2在密闭容器中发生反应的关系如图6所示,判断该反应的热效应及利于反应自发的温度条件。
[学生汇报1]由于反应的△S<0,反应要想自发则△G=△H-T△S<0,故△H<0,且反应在低温条件下有利。
[学生汇报2]也可由图6判断,反应在T3温度下平衡,继续升温CO2浓度升高,说明平衡逆向移动,故△H<0。
[教师追问]利用该反应捕捉CO2,应如何提高CO2的平衡转化率?
[学生汇报]反应是一个放热且气体系数减小的反应,可采取降低温度、增大体系压强(增大CO2浓度)或提高碳酸铵浓度、及时更换吸收剂(分离碳酸氢铵)等方法。
[教师追问]低温可提高CO2平衡转化率,在实际吸收过程中是不是温度越低越好?
[学生汇报]实际工业生产要考虑成本,所以除了关注平衡转化率,还要关注反应时间,即考虑单位时间内的转化率。实际生产中反应可能等不到平衡,这就需要增大反应速率以提高单位时间内的产量。因此CO2吸收过程,虽然降温可增大平衡转化率,但也会降低反应速率,所以要综合两方面因素来选择温度。
[建构分析模型]见图7。
[教师提问]上述分析模型指导我们解决实际工业问题时既要考平衡态、又要考虑非平衡态(速率),据此请思考图6中CO2浓度为什么先降低后升高?
[学生讨论汇报1]从T1~T3区间,是反应建立平衡的过程,升高温度,反应速率加快,一定时间内CO2捕获量随温度的升高而提高;T3温度下,反应达到平衡,继续升高温度,由于正反应是放热反应,平衡逆向移动,相同时间内CO2捕获量随温度的升高而降低。