指向“证据推理与模型认知”的物质结构教学
作者: 王星乔 滕瑛巧 李晶 包朝龙
摘要: 以水合离子作为教学导入,围绕“分析配离子的形成过程”“探究配合物的组成结构”“解释生产生活中的实际问题”等学习任务,精心设计问题,增设证据素材,引导学生通过实验等途径获取证据,基于证据进行分析推理,从而建立、完善配位键(配合物)的认知模型,并运用模型解决生产生活中的实际问题,进而建构“物质结构与性质”模块的认识实践模型,发展学生“证据推理与模型认知”核心素养。
关键词: 证据推理; 模型认知; 配合物; 教学设计
文章编号: 10056629(2022)09005707
中图分类号: G633.8
文献标识码: B
为推进高中化学课堂教学转型,增进教师学科理解,全面落实化学学科核心素养,浙江省教育厅教研室于2021年11月举办了高中化学新课程“关键问题解决”专题研训活动。笔者(本文第一作者)执教了“配合物”这一示范课,受到了与会专家和教师的好评。
1 教学内容与现状分析
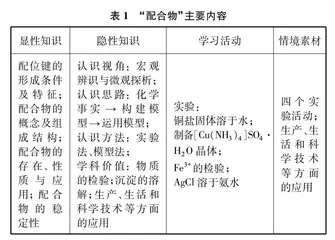
“配合物”为人教版选择性必修2《物质结构与性质》第三章第四节第一课时的新授课。主要内容如表1所示。
在这之前,教材已经安排学习了核外电子排布规律、共价键、杂化轨道理论等内容,为学习配合物奠定了基础。教材设置了四个实验,目的是为构建配位键和配位化合物的认知模型提供载体,使学生真实地感受配合物的存在和初步感知配合物的应用。教材注重化学事实和配合物模型之间的关联和合理匹配,要求运用模型解释或推测物质的组成、结构及其变化,从而学会用学科视角解决生产、生活中与化学相关的实际问题[1]。
根据已有文献,多数教学设计在本课的引入阶段采用无水硫酸铜和胆矾的颜色差异作为问题情境,但在解释配位键形成时却又借助NH3与H+结合成NH+4这一学生熟知的素材,说明水与铜离子形成配位键并不符合学生认知的最近发展区[2]。此外,在“配离子存在电离(解离)平衡”“银镜反应为何要用银氨溶液”等教学内容上存在证据、论证等要素的缺失,无法让学生经历良好的论证过程,难以形成正确的认识。
2 教学思想与创新点
2.1 优化教学导入
本节课以教材《化学反应原理》中“HCl在水中电离示意图”“CH3COOH在水中电离示意图”作为情境素材[3],自然而然地提出“从化学键角度思考H2O是怎样与H+结合的”这一问题,引起情境与学生已有经验(一般共价键)间的认知冲突。此外,从学科视角来看,水合离子在众多物理学、化学、生物学过程中扮演着重要的角色,这一教学导入及后续教学可以让学生认识到,水与其他物质的作用是非常复杂的过程,从理想化的简单处理逐步接近复杂的真实世界[4]。
2.2 增设证据素材
证据是指“能够证明某事物的真实性的有关事实和材料”,其可以分为宏观证据、微观证据、符号证据、定量证据、逻辑证据等类型[5]。证据是进行有效推理的基础,本节课在教材基础上增设了证据素材(见表2),为分析推理提供了事实依据。
2.3 完善论证过程
教学过程中创设真实的问题情境,引导学生基于证据对物质的组成、结构及其变化提出模型假设,通过分析、推理等方法认识“配位键”“配合物”,建立、完善“配位键”“配合物”的认知模型,进而运用模型解决实际问题。其论证过程如图1所示。
3 教学目标
(1) 通过分析H3O+中配位键的形成,概括简单配位键的形成实质及条件,说出配位键与一般共价键的异同,能预测不同微粒间能否形成配位键。
(2) 通过实验真实感受配合物的存在,基于证据建构配合物的认知模型,会运用模型解释配合物的某些典型性质,能结合信息推测简单配合物的结构组成。
(3) 能举例说明配合物在生物学、化学等领域的广泛应用,通过阅读资料了解我国科学家在配位化学领域的杰出成就,培育民族自豪感。
4 教学流程
教学流程见图2。
5 教学过程
5.1 创设情境,旧知新解——分析配离子的形成过程
[展示]HCl、 CH3COOH在水中电离示意图。
[教师]从图中可以看出,H+在水溶液中以水合离子的形式存在,请书写H3O+的电子式并从化学键角度思考H2O是怎样与H+结合的?
[学生]书写电子式并回答: 水分子中的氧原子上有孤电子对,H+的1s轨道是空的,H2O分子中氧原子的孤电子对进入H+的空轨道,它们结合在一起形成了H3O+。
[教师]这一化学键是由水分子提供孤电子对给予H+、 H+接受水分子的孤电子对形成的,这类“电子对给予接受”键被称为配位键。与水合氢离子形成过程相似,氢离子与氨气分子以配位键结合形成铵根离子。
[提问]结合H3O+、 NH+4的形成,思考形成配位键需要满足哪些条件?配位键与一般共价键有何异同?
[学生]形成配位键的一方能够提供孤电子对,另一方具有能够接受孤电子对的空轨道。与一般共价键相比较: 实质是相同的,成键双方共用电子对;差异在于配位键的共用电子对是由一方提供而不是双方共同提供。
[提问]水分子除了可以与H+形成配位键,还可以与哪些常见微粒形成配位键?说说你的依据。
[学生]Na+、 Mg2+、 Al3+、 Fe3+、 Cu2+等离子均有空轨道,理论上都可以形成配位键。
[活动与探究]观察无水硫酸铜颜色,用药匙小头取少量无水硫酸铜于小烧杯中,加入约10mL蒸馏水使其溶解,注意观察现象。
[现象]无水硫酸铜为白色,加水溶解后溶液显蓝色。
[提问]蓝色微粒是什么?请同学们结合教材95页的图3-36思考回答。
[学生]硫酸铜、氯化铜、溴化铜三种固体铜盐的颜色各不相同,但它们的水溶液在一定条件下均显蓝色。可见,蓝色既与Cu2+有关,又与H2O有关,应该是形成了刚才预测的水合铜离子。
[教师]研究表明,上述实验中呈蓝色的物质是水合铜离子,可以表示为[Cu(H2O)4]2+,叫做四水合铜离子。在四水合铜离子中,铜离子与水分子之间的配位键是由水分子提供孤电子对形成的,我们将这种以配位键结合而成的复杂离子称为配离子。
[提供信息]新闻: 科学家首次看到水合钠离子的原子级“真面目”[6]。
[教师]水合离子的概念提出一百多年来,科学家利用扫描隧道显微镜、原子力显微镜成像技术,第一次直接“看到”水合钠离子的原子级图像(见图3)。有资料表明,水合钠离子中存在配位键[7]。水合离子在众多物理学、化学、生物学过程中扮演着重要的角色(电化学反应、生物离子通道等)。
设计意图: H3O+的形成这一问题情境引发学生认知冲突,激发学生寻求问题解决(配位键)以达到认知平衡的欲望。教材“实验32”作为引入配合物概念的第一个实验,尚不能让学生经历良好的论证过程,因而教学过程中在内容和顺序上作了一定的调整,将几种固体铜盐及其溶液的颜色作为证据素材,让学生进行分析论证。此外,新闻材料中水合钠离子的原子层次图像从微观层次上佐证了学生的预测。水合离子素材有以下教学功能: 一方面作为构建配位键认知模型的载体;另一方面让学生感知水就是最常见的配体,在众多物理学、化学、生物学过程中扮演着重要的角色。
5.2 引导探究,突破难点——探究配合物的组成结构
[提问]除水外,是否还有其他电子给予体?
[学生]NH3、 X-、 OH-、 CO……
[活动与探究]取约3mL上述配制的硫酸铜溶液于试管中,向其中滴加氨水并振荡试管,直到最初产生的沉淀恰好溶解为止。
[现象]先产生蓝色沉淀,后沉淀溶解,得到深蓝色溶液。
[讨论]蓝色沉淀是什么?为何会溶解?请运用平衡移动原理加以解释。
[分析]向硫酸铜溶液里逐滴加入氨水,形成难溶物的原因是氨水呈碱性,可与Cu2+形成难溶的氢氧化铜。随着氨水加入,氨气分子与铜离子配位,铜离子浓度降低,使平衡向沉淀溶解的方向移动。实验表明,深蓝色微粒为四氨合铜配离子[Cu(NH3)4]2+, NH3分子中氮原子的孤电子对进入Cu2+的空轨道,以配位键形成了[Cu(NH3)4]2+。
[提问]氨水能够溶解氢氧化铜,说明氨气分子与铜离子间的结合力很强。与水分子相比较,你觉得哪个更强呢?
[学生]氨气分子取代了水分子与铜离子配位,说明铜离子与氨气分子间的配位能力更强。
[结论]配位键的强度有大小之分。
[提问]稳定的四氨合铜配离子能否解离出铜离子和氨气分子?请设计实验方案。
[方案1]取适量深蓝色溶液,滴加Na2S溶液,若出现黑色沉淀,说明四氨合铜配离子能解离出铜离子。
[方案2]取适量深蓝色溶液,滴加过量稀硫酸,氢离子可以与氨气分子结合,若存在解离平衡,则深蓝色会褪去。
[活动与探究]将上述深蓝色溶液一分为二,向其中一份溶液滴加Na2S溶液,另一份滴加过量稀硫酸,观察现象。
[现象]滴加Na2S溶液后有黑色沉淀生成;滴加过量稀硫酸溶液先产生沉淀,后沉淀溶解,溶液颜色明显变浅。
[结论]配离子也存在解离平衡。
[演示实验]取适量深蓝色溶液,加入丙酮,并用玻璃棒摩擦试管壁。
[现象]有深蓝色晶体析出。
[分析]结构测定表明,深蓝色晶体是
[Cu(NH3)4]SO4·H2O,是一种典型配合物。一般来说,把金属离子或原子与某些分子或离子以配位键结合形成的化合物称为配位化合物,简称配合物。在[Cu(NH3)4]SO4·H2O中,Cu2+提供空轨道接受孤电子对,称为中心离子,一般是金属离子或原子,过渡金属最常见;NH3分子提供孤电子对,称为配体,NH3分子中氮原子直接与中心离子相连接,叫做配位原子;配位原子数目叫配位数,Cu2+的配位数是4;Cu2+和NH3分子以配位键相结合,形成配合物的内界;SO2-4为配合物的外界,外界指的是与内界电荷平衡相反的离子。配合物的组成结构如图4所示。
[提问][Cu(NH3)4]SO4在水中能否电离?请给出依据。
[学生]内界和外界靠离子键结合在一起,[Cu(NH3)4]SO4是一种可溶性的离子化合物,在水中能完全电离。
[教师]由内界和外界构成的配合物在水中是完全电离的: [Cu(NH3)4]SO4[Cu(NH3)4]2++SO2-4。
[练习]指出冰晶石(Na3AlF6)中的配离子、中心离子、配位体、配位数、配位原子。
设计意图: 配合物性质的核心在于配离子,据此本环节先完善学生对配位键模型的认识: 配位键的强度有大小之分、配离子也存在解离平衡,进而由内界到外界构建起配合物的认知模型。教学过程展开模拟科学论证过程: 从情境中提出问题,通过实验等方式获取证据,并基于证据进行分析推理,最终获得科学结论[8]。教学过程中设计的一些问题如“蓝色沉淀是什么、为何会溶解、请运用平衡移动原理加以解释”“稳定的四氨合铜配离子能否电离出铜离子和氨气分子、请设计实验方案”,需要学生综合运用平衡移动理论、配位键理论进行分析,以使学生从变化平衡的视角对配合物模型形成较为全面、正确的认识,有利于培养高阶思维。教材中选用乙醇作为溶剂析出深蓝色晶体,所耗时间较长,不适宜作为课堂实验,遂改用丙酮,效果较好。但考虑到丙酮有一定毒性,改为演示实验。
5.3 交流探讨,感知应用——解释生产生活中的实际问题
[过渡]配合物往往是有颜色的,有些配合物显现出特征颜色,从而可以用于物质的检验。例如教材提到的硫氰酸根离子(SCN-)能够以配位键与Fe3+结合呈现血红色。NH3与Cu2+配位生成深蓝色的四氨合铜配离子。此外,配合物在物质制备中的应用也非常广泛。