化工流程题中金属阳离子的转化与分离
作者: 黄智跃 黄宜美 张贤金
摘要: 化工流程题是当下测评学生化学学科核心素养发展水平的优选题型之一,为克服学生的恐慌心理和认知障碍,
帮助学生快速精准地提高阅题效率,
提出“五线并举阅流程”“相变视角看分离”“离子极化辨沉淀”的模型建构策略。以典型高考试题为着力点,运用离子极化理论和溶度积常数这一对定性、定量双引擎分析和解构溶液中金属阳离子逐一或分批沉淀的化学原理与逻辑思维。
关键词: 化工流程; 离子极化; 模型构建; 核心素养; 工程思维
文章编号: 1005-6629(2022)11-0087-05
中图分类号: G633.8
文献标识码: B
1 问题的提出
化工流程题是围绕化工生产或实验室模拟,选择性地进行简化处理[1],以化工素材中的流程为问题情境,将化学知识、工艺条件、实验操作及绿色化学等知识、技能和价值观有机融合的一类试题。此类试题是当下测评学生化学学科核心素养发展水平的优选题型之一[2]。
一个成熟的化工生产方案是以工程思维进行系统分析和比较权衡的筹划性结果,是以解决实际问题为最终目标,基于科学原理,运用技术手段,合理利用资源,以最大效益满足实际需求[3]的整体性、全局性统筹考虑的产物。因此,降低成本、提高效率、获取更大效益(经济效益和社会效益)是实际化工生产必然要考虑的问题。
试卷上所呈现出的化工流程题,面对的是高中学生这一受众,进行选择性地简化处理是必要的。试题设计为了契合高中学生的认知水平,在强调适洽性、针对性的同时,也有其局限性,即呈现出的试题是经命题者修订、加工、整理后的产物,实际的工业生产要更为复杂。
教学实践中发现,阅题时不能快速有效地抓住要领、对常用操作方法的应用场景存在混淆和不能自如应用等是造成学生恐慌的常见原因。
为了帮助学生快速精准地提高阅题效率,提倡采用“五线并举”的阅题策略。
2 “五线并举”阅流程
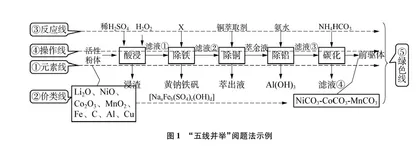
从化学学科视角,要实现物质的转化、分离和提纯,离不开元素的离合,元素的离合又会带来元素价类的转变,价类的转变需要反应来支撑,物质的分离与提纯又需相关实验操作来实现,绿色化学理念贯穿始终。因此,抓住“元素线”“价类线”“反应线”“操作线”“绿色线”这五条线索,有助于在更宽广的视野俯瞰整个流程,有利于迅速地提纲挈领、条分缕析。“五线并举”阅题法示例如图1所示。
例1 福建省2021年高考适应性考试流程见图1。
“五线并举”阅题法的思维模型为:主要金属元素的汇集→金属元素的去留→金属元素价类的转化→反应的选择→操作的实施→绿色的要求。
其具体内涵为:
(1) 元素线:矿样中主要含有哪些金属元素?整个过程需要留下哪种(或哪些)核心金属元素?分离(去除)哪种(或哪些)金属元素?
(2) 价类线:这些主要金属元素以何种价态、类别存在于矿样中?产品中核心金属元素的价类是怎样的?原料中的核心金属元素通过怎样的价类转化而生成产品的?金属离子杂质又是通过怎样的价类转化来分离的?
(3) 反应线:在符合绿色化学、化工实际的前提下应用何种反应有利于金属杂质离子的转化分离以及核心金属元素向产品的顺利转化?
(4) 操作线:在化学原理、物理原理的指引下选择何种操作更有利于实际化工生产?
(5) 绿色线:宏观上,如何实现成本节约、环境保护、节能减排、流程简约、生产自动以实现最大的社会效益和经济效益?微观上,如何选择原料、温和反应、循环利用、环境友好地确立反应进程、生产设备和工艺路线?
抓住以上五条线索,就可以站稳化学学科视角,消除无效信息的干扰而快速入题。
3 相变视角看分离
过滤、蒸发、结晶、蒸馏、萃取、分液等操作都是高中化学的必做实验,遗憾的是,学生对这些分离操作所适用的场景往往来自于对实验的回忆,知识分散,呈点状分布,没有形成系统化、结构化的体系,不利于“促进学生从化学学科知识向学科核心素养的转化”[4]。如果能上升到“相”这一理论高度,就可以在“相变”的指引下实现对知识的浓缩,构建相应的模型和形成结构化网络。
以液液均相转变为异相为例,其分离情境模型建构如图2所示。
相变视角看分离的思维模型为:均相→异相→分离→目标产物。
在制备无机物为主的化工生产中,往往需要对存在于矿物原材料中的诸多金属化合物设法从固相转变为液相,再对液相中的金属离子进行逐一或分批转化为固相难溶物而达到分离之目的。对于液液均相转化为固液异相,过滤是常用的分离方法,该方法具有条件温和、操作简单、成本低廉、方便后续处理等优点,为化工生产所青睐,化工流程题中对金属阳离子的分离也多采用该方法。
化工生产中要考虑的问题复杂而多面,近年来的化工流程题主要以无机化合物的制备为载体,其中金属阳离子的转化与分离是主线之一。面对有选择的简化处理后的化工流程题,为什么碱金属一价阳离子(包括NH+4)往往比较难分离,而二价、三价的金属阳离子经常较容易采用加入沉淀剂使之沉淀的分离方法?其背后的逻辑是什么?有什么理论支撑?
4 离子极化视角辨沉淀
4.1 教师知悉离子极化理论的必要性
回顾高中所学,水溶液中金属阳离子应该形成何种沉淀的主要理论依据是“难溶电解质的溶解平衡”,Qc和Ksp的大小对比可判断该沉淀物能否生成,不同化合物的Ksp数值大小对比可判断其沉淀的先后,该原理从定量角度有力地给予证据支撑。凡事有利也有弊,数据无法展现思维过程,也无法解释其中的思想,并不具备回答“这是为什么”的特质,缺乏感性的魅力。
为了克服Ksp数据思想性上的不足以及过于“冰冷”的缺点,“离子极化理论”给我们提供了一个便利且适合的定性视角。有了离子极化理论和溶度积这一对定性和定量的翅膀,作为执教者的我们就有了更多的工具和更为广阔的视野。教师、学生共同思考并解释溶解度问题的思维模型如图3虚线所示。
学生视角:该情境下某金属阳离子应该形成何种沉淀物→回想溶解性表→找出难溶的化合物有哪些→查阅Ksp数据→根据难溶程度和具体情境找出合适的沉淀物→考虑控制何种条件、加入何种试剂→形成何种沉淀并如何分离。
教师视角:根据离子极化理论→该阳离子的极化能力、变形性如何→该阳离子和何种阴离子生成何种沉淀物比较有利→查阅Ksp数据→根据提供的情境,知晓应控制何种条件加入何种试剂→分析逐一或分批沉淀的合理性→理解整个流程的适洽性、合理性和科学性。
4.2 离子极化理论要点
离子极化理论是在离子键理论和共价键理论的基础上发展起来的。“极化”是指在外电场作用下,使分子、原子或离子的正、负电荷发生相对位移,产生诱导偶极的过程[5]。离子在外电场中所引起的电子云变形称作离子的极化。
一个离子所带电荷虽然很微渺,却集中在如此微小的实体上,也必将产生强大的电场,它的电场使其他离子变形的作用叫“极化作用”,离子使异号离子极化的能力称为该离子的“极化力”,离子本身在外电场作用下发生变形的性能叫“变形性”[6],离子的极化力愈大,表现在被极化的异电荷离子的变形性也就愈大。极化能力和变形性是离子本身具有的双重性质,每个离子作为一个带电体,在诱导邻近离子发生变形的同时,本身亦可以发生变形,阴、阳离子相互极化的结果,彼此的变形性增大,这种阴、阳离子相互产生诱导偶极从而加强了离子间极化能力的过程,称为离子间的附加极化。离子的电子层构型对附加极化的大小有重要的影响。每个离子的总极化作用应是原来的极化作用和附加极化作用之和,离子极化与键型的关系见图4[7]。
离子极化力决定了它对邻近离子施加静电场的强度,卡特雷奇(G.H.Carteledge)[8]用“离子势”即离子电荷与离子半径之比(φ=Z/r)来表示阳离子的极化能力,该定义是从经验导出的,不可能符合所有事实。邵俊、温元凯等提出用离子有效核电荷与半径来标度极化力:离子极化力=Z*2/r,徐光宪等提出用φ=Z/r2或φ=Z2/r[9]等函数关系式表示离子势,以符合另一些事实。表示方法虽有不同,但都说明离子的电荷、半径对离子极化能力有重要的影响,当电荷或半径相近时,正离子极化能力由离子的电子层构型决定,其大致关系为:18e-或(18+2)e->9e-~17e->8e-或2e-。王稼国等强调要考虑13e-和18e-这类半充满和全充满电子构型离子的特殊性,这两种电子构型离子的有效电荷略低于同周期前后相邻的离子,其极化能力也较弱[10]。
当然,正离子也存在变形性,一般说来,正离子的φ越大,本身变形性越弱,而含dx电子的正离子变形性一般较强,如Ag+的极化能力和变形性都较大。负离子也存在极化能力和变形性,由于其Z(电荷数)<0,故φ<0,因此,φ越大,变形性一般也越大[11],如体积大的负离子,因其r大,φ大,所以变形性也大。离子极化作用的关联概念和影响因素见图5。
离子极化和无机物的颜色、溶解性、熔沸点、热稳定性等物理化学性质都有密切的关系。应用离子极化理论解释无机化合物相关性质的思维模型见图6。
4.3 离子极化作用对无机化合物溶解度的影响
水的介电常数很大(约等于80),正负离子间的吸引力在水中可以减小80倍,很容易受热运动的作用而互相分离[12],因此,离子晶体一般易溶于水。而介电常数不会使共价键的结合力减弱,所以共价化合物一般难溶于水。
徐光宪、王祥云[13]把Z2/r的大小作为极化程度或溶解度大小的度量。
(1) 最外能级组充满或具有惰性气体原子结构的正离子和含有fx或锕系及镧系元素正离子:
① Z2/r<0.02(r以pm为单位),这类金属离子(Li+、 Na+、 K+、 NH+4、 Rb+、 Cs+、 Fr+)只有很大的阴离子才可使之沉淀,如PtC12-6可使K+, NH+4, Rb+, Cs+, Fr+沉淀。
② 0.07>Z2/r>0.02,这类金属离子(Mg2+、 Ca2+、 Sr2+、 Ba2+、 Ra2+)的硫化物和氯化物溶于水,氢氧化物微溶于水,碳酸盐不溶于水。这一组金属离子可用(NH4)2CO3作为沉淀试剂,把它们沉淀下来。
③ Z2/r>0.07,这类金属离子(Be2+、 Al3+、 Sc3+、 Y3+、 La3+、 Ti4+、 Ce4+)的硫化物和氢氧化物不溶于水,在系统定性分析的条件下,可作为氢氧化物沉淀下来。
(2) 含有dx或过渡金属离子的硫化物难溶。
5 例析“离子极化作用”“溶度积”应用于化工流程题中金属阳离子的沉淀与分离
例2 2019年全国Ⅲ卷第26题流程见图7。
高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、 Al、 Mg、 Zn、 Ni、 Si等元素)制备。
该流程涉及的金属元素有:Mn、 Fe、 Al、 Mg、 Zn、 Ni,最终需留下的是Mn元素,其他离子要逐一或分批沉淀进行分离。
5.1 铁、铝的沉淀分离分析
根据离子极化理论,Al、 Fe转变为+3价阳离子时,极化能力大,水溶液中通过调节pH使之成为氢氧化物沉淀比较有利,各相关离子氢氧化物的Ksp数据[14]见表1。表1数据显示,Fe(OH)3、 Al(OH)3的Ksp数值要比其他四种小很多,通过调节溶液pH使之先沉淀进行分离是合理的。
5.2 镍、锌的沉淀分离分析
剩下四种元素Mn、 Mg、 Zn、 Ni,同理,从极化理论出发,Mg2+的0.07>Z2/r>0.02,难以形成硫化物沉淀。另外三种离子的硫化物溶解度小,可以考虑形成硫化物沉淀。