基于核心素养的高三化学深度复习课例研析
作者: 郑文昌 曹星
摘 要 以“离子反应”为例阐述基于核心素养的高三化学深度复习,分析深度复习的背景和复习目标,详细呈现教学过程,并对教学效果进行检测和反思。基于核心素养的高三深度复习的关键:创设真实的教学情境,设计不断深入的问题链;在解决实际问题中促进知识关联结构化、认识思路结构化、核心观念结构化;“教、学、评”一体化,提升学生认识素养。
关键词 高中化学 核心素养 深度复习 “教、学、评”一体化
一、背景分析
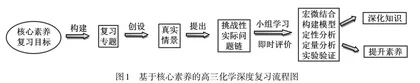
传统的高三化学第一、二轮复习通常缺少基于学情、以提升学科核心素养为目标的、对知识进行整合的深度复习。学生的复习仅停留在对知识的简单回顾,这种浅层次的复习会形成碎片化的知识、肤浅的理解和僵化的思维[1]。而基于核心素养的深度复习是以化学核心素养为复习目标,挖掘课程内容中知识间的逻辑关系,找出这些知识内容在培育学科素养中所蕴含的功能价值,将这些内容优化重组形成复习专题或主题,以真实的情境为载体,以化学知识为解决问题的工具,以提出的实际问题为任务,引导学生主动参与,融入即时性评价,在解决问题的过程中深化对知识的理解,提升核心素养,其教学流程如图1所示。
科学教育的主要目的是培养和发展学生的认识素养。当一个学生具备良好的化学认识素养,他就能从客观世界(复杂的社会现象和生活问题)抽取认识阀,对化学问题进行多角度分析,形成认识思路,养成学科能力[2]。
“离子反应”是从微观视角认识化学反应本质的重要核心概念,是培养学生“宏观辨识与微观探析”“变化观念与平衡思想”的重要的知识内容。经过前期的学习与复习,学生基本掌握了“离子反应”相关知识,如电解质、非电解质等概念的辨析,离子方程式的书写,离子共存等问题,对于平衡(电离平衡、水解平衡、沉淀溶解平衡)问题也比较熟悉。然而在复习过程中发现,学生在解决实际化学反应问题时不能主动从“平衡观”“微粒观”“变化观”的视角来分析化学问题,不能基于新的问题情境定性和定量地分析化学反应的动态变化,存在化学认识素养的欠缺。“宏观辨识与微观探析”“变化观念与平衡思想”是化学学科认识世界的重要视角,对“离子反应”的深度复习,有利于提升学生的认识素养。
二、复习目标的制定
(一)复习目标制定依据
1.基于“离子反应”课程内容特点分析。从“离子反应”课程内容(见表1)来看,主要涉及平衡(电离平衡、水解平衡、沉淀溶解平衡)问题,其中蕴含着平衡观、微粒观、变化观、量变引起质变等学科观念,对该知识内容的深度复习可使离子反应核心观念结构化(见图2),有利于培养学生“宏观辨识与微观探析”“变化观念与平衡思想”核心素养,提升认识素养。
2.基于“离子反应”与素养水平关联分析。根据《课标》(2017年版)附录1对化学学科核心素养水平的划分,对“离子反应”与素养水平的关联进行了整理(见表2)。学业质量水平2是高中毕业生在本学科应该达到的合格要求,是化学学业水平合格性考试的命题依据,学业质量水平4则是化学学业水平等级性考试的命题依据[4]67,本课复习目标的确定主要是以化学学业水平4为依据。
3.基于学情进行分析。经过前期的复习,学生对离子反应及平衡知识比较熟悉,对“离子共存”“离子方程式的书写”及利用平衡知识解决简单的常规问题比较熟练,但是学生在解决化学实际反应问题时不能主动从“平衡观”“微粒观”“变化观”的视角来分析,不能从不同视角认识化学变化的多样性,不能运用对立统一思想和定性定量结合的方式来分析生产、生活实际中的化学变化。
(二)复习目标
1.通过典型的“离子共存”问题的讨论,诊断学生“离子反应”知识关联的程度,完善知识关联,使“离子反应”知识的关联结构化。
2.通过综合运用离子反应,从动态平衡、微粒、定性与定量等视角分析和解决生产、生活中有关电解质溶液的实际问题,建立“离子反应”结构化的认识思路,拓展认识视角。
3.通过检测练习的讨论,诊断和评价应用“离子反应”结构化认识思路来解决问题的情况,运用对立统一思想和定性定量相结合方式来分析实际化学反应问题,提升学生认识素养。
三、教学过程
(一)在解决典型习题的过程中促进“离子反应”知识关联结构化
设置任务情境1,通过任务1的讨论,让学生自我发现知识储备的不足,主动完善知识结构,使“离子反应”知识关联结构化。
【任务情境1】下列离子组在溶液中都不能大量共存,请同学们分析每组离子发生了哪类反应导致离子不能共存。
A.Fe3+、SCN-、I-、K+ B.K+、Al3+、SO32-、MnO4-
C.H+、NO3-、Fe2+、Na+ D.Cu2+、NH4+、Br-、OH-
【学生活动】分析每一选项中离子不能大量共存的原因,小结“离子反应”涉及的反应类型。
【教师活动】针对学生回答中存在的问题,用追问的方式引导学生发现自己储备知识的不足。
【学生活动】构建“离子反应”涉及的反应类型及常见的氧化剂、还原剂、弱电解质、难溶物、配合物等知识。
【教师活动】以追问的方式引导学生思考:为什么题目中强调“大量”?H+与OH-会反应生成弱电解质水,为什么水溶液中H+与OH-会“共存”?让学生深刻体会:“离子反应”的本质是离子的种类或数目发生了改变,它涉及到平衡移动等理论知识。
【学生活动】构建“离子反应”知识关联结构模型,如图3所示。
【教师评价】对学生构建的知识关联模型给予点评、完善。
(二)在真实情境中设计问题链,在解决问题中促进认识思路结构化、核心观念结构化
抓住“强制弱”“弱制强”的典型案例,设置梯度任务情境3、4、5,并根据任务情境设计层层深入的问题链作为学习任务,引导学生从定性与定量两个方面来分析离子反应,让学生从变化观、平衡观、量变引起质变的视角来认识离子反应,构建离子反应的认知思路。
【任务情境2】在试管1和试管2中分别加入2 mL蒸馏水,在试管1中加入少量粉末后试管中出现浑浊。
【学习任务1】试管1中有Ca2+吗?请设计实验来验证,并用沉淀溶解平衡的方程式来解释原因。
【学生活动】预测试管1是否有Ca2+,设计实验验证,书写沉淀溶解平衡的方程式。
【教师评价】学生解决问题情况:可通过测导电率等方法来验证试管1的浊液中存在Ca2+,在水中碳酸钙存在CaCO3[]CO32-+Ca2+平衡。
【任务情境3】在上述的试管1中滴加盐酸,浑浊变澄清。
【学习任务2】请同学们从沉淀平衡移动的视角定性分析加入盐酸后CaCO3浊液变澄清的原因。
【学生活动】宏观现象微观探析:从平衡移动的视角分析CaCO3溶于盐酸的离子反应。
【教师评价】学生是否有宏观辨识与微观探析的自觉性,与学生一起构建碳酸钙溶于盐酸的微观探析模型,如图4所示。
【学习任务3】请大家从Ksp与Qc角度定性分析碳酸钙溶解的原因。
【学生活动】定性讨论加入盐酸前后Ksp与Qc的大小,确定碳酸钙沉淀溶解平衡移动的方向。
【教师活动】加入盐酸之前,Ksp = c(Ca2+) × c(CO32-) = Qc,加入盐酸后,Ksp > Qc,平衡向溶解的方向移动。
【学习任务4】已知:Ksp(CaCO3)= 2.8 × 10-9,H2CO3的K1 = 4.4 × 10-7、K2 = 4.7 × 10-11。请大家从平衡常数K 的角度定量分析碳酸钙溶解的原因。
【学生活动】思考、计算、讨论。
【教师活动】如果不考虑碳酸分解,可根据下面反应来计算平常数K:
2H+ + CaCO3 = H2CO3(aq) + Ca2+
K=[c(Ca2+)·c(H2CO3)c2(H+)]=[c(Ca2+)·c(H2CO3)·c(HCO-3)·c(CO2-3)c(CO2-3)·c2(H+)·c(HCO-3)]=[Ksp(CaCO3)K1(H2CO3)·K2(H2CO3)]
=[2.8×10-94.4×10-7×4.7×10-11=1.35×108]
可见,在碳酸钙浊液中加入盐酸,生成了碳酸,此时平衡常数已经很大;若碳酸分解,反应生成二氧化碳和水,平衡常数会更大,所以碳酸钙可以溶解在盐酸中。
【学习任务5】碳酸钙可溶于强酸盐酸中,是否也能溶于醋酸等其他弱酸中?我们可以从哪些视角进行分析?
【学生活动】思考、讨论。
【教师活动】我们可以从Ksp与Qc、平衡常数的视角定性和定量分析平衡移动的可能性,从而判断碳酸钙是否可溶解于其他弱酸中。当然,反应可能受到酸的浓度等其他条件的影响,有兴趣的同学可在课后进行讨论。
【教师活动】上面我们讨论的盐酸与碳酸钙反应生成碳酸、碳酸不稳定分解生成二氧化碳和水,其反应都属于“强制弱”中强酸制弱酸的范畴。那么,弱酸能否制强酸呢?溶解度小的物质能否转变成溶解度大的物质呢?
【任务情境4】演示实验:把硫化氢气体通入硫酸铜溶液中,有黑色固体生成。
【学习任务6】观察实验现象,分析反应产物,写出反应的化学方程式和离子方程式。
【学生活动】观察、思考,书写反应化学方程式和离子方程式。
【教师评价】评价学生书写的化学方程式和离子方程式,追问:硫化氢为弱酸,为什么可以用它制备强酸硫酸呢?
【学习任务7】请同学们从离子反应及平衡移动的视角定性分析H2S制备H2SO4的可能性。
【学生活动】思考、讨论。
【教师评价】从反应Cu2+ + H2S = CuS↓+ 2H+可知,铜离子促进了H2S在水溶液中的电离,通过图5的微观分析模型体会铜离子促进H2S可能电离彻底的微观过程。
【教师追问】从CuSO4 + H2S = CuS↓+ H2SO4可知,CuS不溶于强酸硫酸中。图5从定性的视角分析反应的可能性说服力不够,同学们能否从化学平衡常数的视角定量分析反应的可能性呢?
【信息提示】298K时,Ksp(CuS) = 1.27 × 10-36, H2S的[Ka1]= 9.1 × 10-8,[Ka2]= 1.1 × 10-12。
【学生活动】思考、讨论、计算。
【教师评价】根据Cu2+ + H2S = CuS↓+ 2H+,可以计算其平衡常数如下:
K=[c2(H+)c(Cu2+)·c(H2S)]=[c2(H+)·c(S2-)·c(HS-)c(Cu2+)·c(S2-)·c(HS-)]=[9.1×10-8×1.1×10-121.27×10-36=7.88×1016]
平衡常数K = 7.88 × 1016,很大,所以硫酸铜溶液与硫化氢气体反应可以制得硫酸。
【学习任务8】H2S通入CuSO4溶液中可制得硫酸,那么,H2S通入FeSO4溶液中能否制硫酸呢?SO2通入BaCl2溶液中能否制盐酸?我们可以从哪些视角进行分析和思考?
【学生活动】思考、交流讨论、分享讨论结果。
【教师评价】我们可从平衡移动、平衡常数的视角分析反应的可能性,再进行实验验证。
【学习任务9】CuS不溶于强酸硫酸中,请分析其溶解于强酸硝酸的可能性,并设计实验验证。