凸显模型建构 落实核心素养
作者: 张宇 苗颖
关键词:高中化学;模型建构;位—构—性;核心素养
中图分类号:G633.8 文献标识码:B 文章编号:1009-010X(2023)20/23-0125-04
一、教材分析
“元素周期律”是高中化学知识体系中重要的理论基础,其核心为元素性质的周期性变化规律及其应用,该课程内容揭示了原子结构与元素性质之间的关联,既是对已有元素化合物归纳总结,又是对未知元素化合物的发现理论指导,是学生建构完整知识结构的重要支撑。从科学方法角度看,本节课通过“提出问题——实验设计与验证——得出结论”的探究思路,帮助学生形成科学研究的一般思路和方法,建立元素的认识模型。从学科能力角度看,本节课借助实验和事实,发展学生归纳、演绎、证据推理、模型认知与建构等的科学探究能力、逻辑思维能力以及迁移能力。
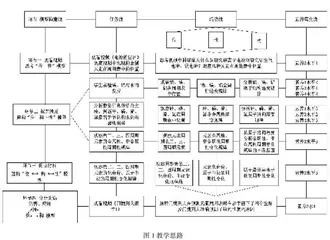
二、教学思路
本节教学设计以元素在周期表中的位置为明线,以学生对元素“位—构—性”的认识为暗线。教学思路设计见图1。
三、教学过程
环节一:观看视频,构建“位—性”模型
【创设情境】播放视频“电池的世界”引发学生思考:科学家是如何从锂离子电池联想到钠镁铝电池的?
【活动】展示元素周期表,引导学生观察Na、Mg、Al元素在周期表中的位置,并思考3种元素的共同特征及位置特点。
设计意图:创设新型电池材料发展的真实问题情境,激发学生兴趣,引发学生思考周期表位置与元素性质的关系。
环节二:探究性质,建构“位—构—性”模型
任务一 探究钠、镁、铝元素金属性强弱。
【活动】讨论判断元素金属性强弱的依据,探究金属钠、镁、铝与水的反应。记录实验现象,并进行归纳总结。
【引导】从原子结构角度分析金属性强弱变化的规律,对物质的性质呈现元素的性质进行解释。
【演示实验】向氢氧化镁、氢氧化铝中分别滴加氢氧化钠溶液。
【总结】铝虽是金属,也表现出了一定的非金属性。
设计意图:利用已有知识,设计探究实验,通过问题串明晰物质结构决定性质,初步构建思维模型。学生通过完成任务,明确了研究元素性质的方法。在探究的过程中落实“宏观辨识与微观探析”“科学探究与创新意识”的学科素养。
任务二 探究元素周期表中元素金属性、非金属性的周期变化规律。
【活动1】跟据硅、磷、硫、氯四种元素在周期表中位置,预测其非金属性强弱。参考研究元素金属性强弱的方法,得出判断元素非金属性强弱的依据。
【活动2】根据判断依据和资料信息,设计实验方案证明预测结果。
【资料1】硅、磷、硫、氯最高价含氧酸化学式分别为:H2SiO3、H3PO4、H2SO4、HClO4。
【资料2】硅酸H2SiO3,溶解度很小。可通过可溶性硅酸盐与其他酸反应生成的H2SiO3,聚合成胶体——硅酸溶胶(浓度较大时形成软而透明胶冻状的硅酸凝胶)制备。
【实验试剂】4mol /L H3PO4、0.1mol/L H3PO4、0.1mol/L H2SO4、1mol/L Na2SiO3、笔式pH计、蒸馏水、酚酞。
【学生】小组讨论,形成实验方案,运用pH计测定0.1mol/L磷酸、0.1mol/L硫酸pH,实验结果如表1(方案2、3的实验数据为三组学生实验的平均值)。
方案1:磷酸制硅酸。
方案2:运用pH计测定0.1mol/L磷酸的pH。
方案3:运用pH计测定0.1mol/L硫酸的pH。
【学生】得出结论:元素非金属性强弱顺序为:硅<磷<硫<氯。
【提问】从原子结构的角度来看,元素非金属性为什么有这样的规律?
【学生】与原子最外层电子得电子能力有关,硅、磷、硫、氯半径依次减小,最外层电子数依次增加,得电子能力依次增强,非金属性依次增强。
【总结】以上实验设计再次验证了“结构决定性质”的化学观念。即第三周期元素从左到右金属性渐弱,非金属性渐强。结合第2、4周期的研究事实,可得出元素性质周期性变化的规律。
设计意图:利用任务一建立的思维模型,判断非金属性强弱,使学生思维获得螺旋式上升。通过任务二再次构建“位—构—性”关系,加深对模型的认知。通过信息资料,培养学生获取信息和合作学习能力。在探究的过程中再次落实“宏观辨识与微观探析”“科学探究与创新意识”的学科素养。
环节三:阅读材料,建构“位?圮构?圮性”模型
任务三 探究化合价、原子半径的变化规律。
【阅读材料】
资料卡片
新型电池材料的研究,除了考虑到元素在地壳中的含量,还要考虑到这种金属材料本身的电极电势及能量密度,而单位质量的金属化合价变化越大,越能优化电池能量密度的性能。(如图2)
【学生】挖掘信息:电池材料的选取除了要考虑本身在地壳中的含量,还需要考虑金属的化合价。
【活动】展示元素周期表及前三周期元素的化合价、原子半径数据图、前18号元素化合价柱状图、主族元素原子半径变化周期变化图。引导学生思考决定元素的金属性、非金属性、化合价、原子半径呈周期性变化的本质原因。
【提问】通过完成任务一、二、三,同学们对原子结构与元素性质之间的关系有什么认识?
【学生】原子结构决定元素性质,元素性质反映了原子结构;原子结构决定元素在周期表的位置,元素在周期表中的位置反映了原子结构。
设计意图:再次关联电池材料选择,引发学生思考材料选择与金属化合价之间关系,引出元素化合价、原子半径随着原子序数递增的变化规律。每次的学生任务都从元素在周期表的位置入手,学生对元素“位—构—性”的逐步认识作为教学暗线,反复引导学生感悟元素在周期表中的位置与原子结构、元素性质之间的关系,逐步构建“位—构—性”模型。在做任务中总结规律,从而理解周期概念,落实“证据推理与模型认知”的学科素养。运用数据、事实分析,从宏观与微观结合角度理解元素周期性变化的规律,再次落实“宏观辨识与微观探析”的学科素养。
环节四:
分析史话,完善、应用“位?圮构?圮性”模型
任务四 观看视频,分析元素的性质和元素位置的关系。
【播放视频】看完“门捷列夫很忙”视频后思考,门捷列夫为什么在表中留下四个空格?他又是如何准确预测了镓的性质呢?
【学生】门捷列夫发现了元素周期律,根据元素的性质可以推断出元素的位置,因此留下了四个空格,由元素的位置同样可以推断出元素的性质,由此门捷列夫又准确预测了镓的性质。
【构建模型】构建“位—构—性”关系模型。
【拓展应用】最近几年,科学家们又开始研究钾离子电池,如果你是科学家,还会用哪些元素来做电池的材料?
【学生】思考、讨论、交流,通过构建的“位—构—性”模型预测铯离子电池、钙离子电池。
【展望未来】新型电池作为新能源领域的重要组成部分,对全球的经济、军事及生活等方面发挥着举足轻重的作用。科学家一直努力探索更经济、安全的电池材料,希望在不久的将来,同学们可以运用今天所学的化学知识探索到性能更优的电池材料,使一个无化石燃料的社会成为可能!
设计意图:回顾科学史及预测新型电池材料,再次落实“证据推理与模型认知”的学科素养,巩固认知模型,形成结构决定性质的学科思想。通过贯穿始终的真实教学情景,树立绿色环保化学理念,落实“科学态度和社会责任感”的学科素养。
四、教学反思
(一)设真实情境,学有用化学
本节教学共用到三次和“电池材料”相关的真实情境。第一次引发学生思考“位—性”之间的关系。第二次以资料的形式引发学生思考化合价与电池材料选择的关系,从而引入对第三周期元素原子化合价及半径的规律的思考,建构“位—构—性”模型。第三次,学生通过本节课的学习学会了运用元素周期律来解决生活生产中的问题,认识并理解了“位—构—性”之间的关系。三次情境的运用为构建、应用模型提供了真实的依据、环境,有利于促进学生宏观辨识与微观探析、证据推理与模型认知、科学探究与创新意识、科学精神与社会责任4个化学学科核心素养的形成和发展。
(二)创实验条件,显学科特点
实验是学习物质的方法,也是科学探究的重要途径。本节课进行了两次学生实验,通过实验学生判断出第三周期硅、磷元素非金属性强弱。备课时,教师对实验进行多次探索和改进,如:常温下1mol/L Na2SiO3、6mol/L H3PO4的条件,能够迅速生成硅酸胶体;Na2SiO3固体要溶解在沸水中增大其溶解度;对比0.1mol/L H3PO4与0.1mol/L H2SO4酸性强弱时,采用笔式pH计快捷记数。
(三)需改进的内容
1.本节为单课时设计,没有单元整体设计,如果把元素周期表与元素周期律的教学有机地结合起来,学生“位—构—性”模型的认识会更深刻。
2.本节教学设计能体现教学评价的重要性,但学生的课堂生成与课前预设不一致,应注重及时客观精准评价学生、以评价促进核心素养提升等问题。