细胞的生与死
作者: 杨冬1951年,一位名叫海瑞塔·拉克斯(Henrietta Lacks)的年轻黑人女性因子宫颈癌被送往美国约翰·霍普金斯医院接受治疗。尽管医生竭尽全力挽留她年轻的生命,但拉克斯最终还是未能战胜病魔,不幸逝世。不过,拉克斯的一部分细胞却意外地存活了下来。
当时,科学家们正致力于实现人体细胞的长期体外培养,但所有尝试都以失败告终,因为细胞分裂到一定次数后便会死亡。这引发了一个问题:是否有可能让人体细胞在体外无限分裂,从而创造出一种“不死”的细胞系?
在为拉克斯治疗的过程中,约翰·霍普金斯医院的科研人员从其体内提取了部分肿瘤组织样本。当拉克斯的肿瘤组织样本被送到研究人员乔治·盖手中后,他发现这些细胞在体外培养条件下竟然能够无限繁殖。这一发现标志着人类历史上第一种“不死”细胞系—海拉细胞(HeLa cells)的诞生,其名称来源于海瑞塔·拉克斯姓名的缩写。
在随后的几十年里,海拉细胞被广泛繁殖,并在生物医学研究中扮演了关键角色。据估计,迄今为止,世界各地的研究者培养出的海拉细胞的总重量已超过5000万吨。这不禁让人好奇,为何普通细胞难以实现“永生”,而海拉细胞又有何独特之处?
为什么细胞会衰老
1961年,美国科学家列奥纳德·海夫利克在研究中发现,在常规条件下,从人体组织中分离的细胞经过一定次数的分裂后会逐渐失去继续分裂的能力,他将这一现象称为细胞衰老。海夫利克的研究显示,从人体组织中分离出的成纤维细胞(结缔组织中最为常见的细胞)最多只能分裂60次左右。实际上,对于正常人体来说,这个数字已经足够多,一个人从出生到死亡,细胞分裂的次数远未达到这个极限。
海夫利克后续的研究进一步发现,从衰老个体(老年人)中分离出的细胞,其分裂次数更少,这可能是因为这些细胞在衰老个体中已经消耗了大部分分裂潜能。然而,这种有限的分裂次数仅适用于普通体细胞,对于胚胎干细胞而言,只要它们保持在胚胎干细胞状态,就能够持续分裂。这似乎表明人体对细胞的分裂能力设定了限制,除非是为了繁殖后代(如胚胎干细胞),否则细胞的寿命是有限的。
那么,为什么会有这样的限制呢?科学家认为,这种限制的一个主要作用是预防癌变。如果某个细胞发生基因突变,其分裂不再受限,最终将发生癌变并形成肿瘤。幸运的是,人体形成肿瘤的概率远低于细胞发生此类突变的概率。换句话说,只有当突变细胞突破海夫利克极限—60次左右时,它们才可能实现“永生”,进而转变为癌细胞。
可见,细胞寿命的限制增加了癌症形成的难度;反之,癌变的细胞必然已经超越了海夫利克极限,实现了“永生”。正是“永生”这一特性,让海拉细胞在生物医学研究中发挥了巨大的作用。
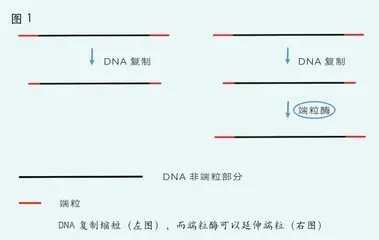
克服细胞衰老仅仅是迈向“永生”之路的起点。尽管某些细胞通过突变能够突破海夫利克极限,但它们在持续分裂的过程中还会面临“端粒危机”(见图1)。端粒是位于细胞DNA两端的特定序列,在每次细胞复制DNA时它们都会略微缩短。可以预见,随着细胞分裂次数的增加,端粒会变得越来越短,最终导致染色体两端的融合,进而在细胞分裂时被拉断。这一过程会使细胞基因组越来越不稳定,最终导致细胞死亡。可见,端粒是限制细胞寿命的一个关键因素。
在所谓的“永生”细胞(如胚胎干细胞)中有一种独特的酶,名为端粒酶,它能够在DNA复制后延长端粒的长度,从而避免“端粒危机”。相比之下,普通体细胞通常无法产生端粒酶。如果我们将端粒比作一个不断倒数的计时器,那么端粒酶就相当于一个重置按钮,令拥有端粒酶的细胞能够不时重置计时器。然而,由于缺乏端粒酶,普通体细胞无法重置计时器。因此,科学家推断,在细胞转变为癌细胞之前,它必须能够有效地产生端粒酶,以支持其无限繁殖的特性。
细胞的生长、分裂和死亡
在单细胞生物中,每个细胞都表现出“自私性”,尽管它们之间偶尔也会合作,但每个单细胞生物的主要目标是繁殖更多自己的后代。相比之下,多细胞生物则是一个整体。为细胞设定寿命上限是多细胞生物为了保障个体生存而采取的一种“战略性设计”。这种设计从根本上限制了细胞的“自私行为”。
在多细胞生物体(简称生物体)中,除了少数负责繁衍后代的生殖细胞,其余细胞被称为体细胞。这些体细胞的基本任务是维持生物体的当前状态,从而为生殖细胞提供繁殖下一代的机会。由于体细胞具有不同的特性和功能,它们各司其职、相互协作,从而在很大程度上丧失了独立生存的能力。这种细胞间的协同工作是多细胞生物能够作为一个整体运作的关键。
在生物体内,细胞的分裂能力受到精密的调控。它们仅在必要时进行分裂,且分裂次数是有限的。此外,细胞的生存也受到周围环境的严格控制。在许多情况下,一旦细胞完成了它们的任务,就会被诱导进行自我毁灭。例如,在生物体被病原体感染时,作为特异性免疫反应的一部分,产生特定抗体的B淋巴细胞会大量增殖。随着感染的消退,大多数B淋巴细胞也逐渐走向死亡。如果没有这种死亡机制,随着个体经历的每一次感染,体内的B淋巴细胞数量将会指数级增长,最终导致血液中充斥着这些细胞,这对个体的生存显然是不利的(部分淋巴细胞可能因突变而发展成白血病或淋巴瘤)。
那么,在生物体内,细胞的生长、分裂和死亡是如何被调控的呢?这就会涉及癌基因和抑癌基因。许多癌基因实际上起源于那些促进细胞生长的基因。通常,突变导致这些基因失去了正常的调控能力。一个重要的例子是表皮生长因子受体(EGFR),它是一种位于细胞膜上的蛋白质,参与了许多恶性肿瘤(如结肠癌和肺癌)的形成。在正常情况下,EGFR能够接收来自细胞周围环境的增殖信号,即表皮生长因子(EGF)。EGF与EGFR结合后会将细胞增殖信号从细胞外传递到细胞内,引发细胞生长和分裂。有些肿瘤细胞会产生突变的EGFR,即使没有与EGF结合,它们也能保持活性,从而在细胞内部“无中生有”地传递增殖信号。拥有这些突变EGFR的细胞会不断增殖,而编码这些突变EGFR的基因就是癌基因。
在临床实践中,通过小分子药物或大分子抗体药物抑制EGFR的活性,可治疗多种恶性肿瘤。特别是在某些非小细胞肺癌的治疗中,这种疗法已经显示出显著的疗效。
细胞中不仅存在促进细胞增殖的基因(潜在的癌基因),还有一类基因专门抑制细胞增殖,甚至能触发细胞自我毁灭,它们被称为抑癌基因。其中,编码P53蛋白的基因是一个典型的例子。研究者发现,在30%~50%的人类恶性肿瘤中,编码P53蛋白的基因都发生了突变。如果通过基因工程技术敲除小鼠的编码P53蛋白的基因,这些小鼠的寿命会非常短暂,通常会很快死于恶性肿瘤。P53蛋白在细胞内充当着监控器的角色,能够响应多种可能导致肿瘤的因素,如低氧、辐射、转录受阻、癌基因的表达等。P53蛋白还能促进DNA修复、阻止细胞分裂、促进细胞衰老,甚至引发细胞凋亡(细胞自我毁灭)。可以说,P53蛋白的主要任务是防止细胞癌变,所以编码P53蛋白的基因是一种重要的抑癌基因。
进化视角下的癌细胞
从正常的体细胞转变为癌细胞是一个复杂而漫长的过程,因此大多数人并未在一生中不断遭受癌症的侵袭。
细胞必须经历一系列突变,激活潜在的癌基因,从而获得持续增殖的能力。同时,它们还需要消除抑癌基因的作用,以免增殖被阻断或被迫自我毁灭。此外,细胞还需要产生端粒酶,以获得无限的复制能力。即便如此,实现了“永生”的细胞也未必就是癌细胞。“永生”是成为癌细胞的必要条件,但非充分条件。癌细胞的形成还需要细胞具备侵入邻近组织以及远距离转移的能力。因此,癌细胞的最终形成是一连串突变累积的结果,在某种程度上,该过程可以被视为人体内部的一种“进化”现象(见图2)。

从进化的视角来理解癌症的形成,有助于我们深入认识这一疾病。我们可以想象,在生物体组织中,某个细胞发生突变并获得“永生”特性后,它将能够无限制地分裂,从而在与邻近细胞的竞争中占据优势,最终可能发展成肿瘤(不一定是恶性肿瘤)。随着细胞的持续分裂,更多的突变随之产生,如果其中某个突变赋予细胞更快的生长速度、侵袭周围组织的能力或逃避免疫系统攻击的能力,那么这些带有新突变的细胞将具有更大的生存优势,并在肿瘤中取代其他细胞,使得肿瘤的恶性程度不断增加。随后,新的突变可能使细胞获得通过血液或淋巴系统定植到远处器官或组织并产生形成新肿瘤的能力。这些细胞能够繁殖更多的后代,形成多处转移瘤,而新的肿瘤均由这些具有转移能力的细胞构成,因此带有新突变的细胞将成为生物体内主要的肿瘤细胞。随着时间的推移,肿瘤细胞之间的竞争将促使更具侵袭性的肿瘤进化,对人体的危害也随之增加。
因此,如果能及早得到治疗,恶性肿瘤患者的预后通常会相对较好,原因正在于此。当然,我们的描述是高度简化的,肿瘤细胞的突变并非线性过程,肿瘤往往表现出异质性,即一个肿瘤内包含不同突变的细胞,并具有不同的进化历程。
在多细胞生物中,细胞的生与死是一个至关重要的问题。尽管许多人梦想着“永生”,但如果构成我们的体细胞真的实现了“永生”,那将是最大的噩梦,因为这意味着恶性肿瘤的不断增殖,最终导致死亡。细胞的生与死构成了一种可转化的、动态的辩证关系,保持关系平衡才能让生命健康且有活力地延续下去。
【责任编辑】张小萌