乙醛不能使溴的四氯化碳溶液退色吗
作者: 朱马尔 刘永珍 赵雪 徐延渭
摘 要:综合分析近期文献中有关乙醛能否使溴的四氯化碳溶液退色的研究与表述。通过实验验证了乙醛能使溴的四氯化碳溶液退色,打破了高中教学中对于这部分知识的原有认知。通过验证反应过程中产生的气体,以及改用甲醛进行对比实验,确认了乙醛与溴之间反应的基团,并进一步探讨了其反应机理。从实验和理论两个方面证实乙醛可以使溴的四氯化碳溶液退色。
关键词:乙醛;溴的四氯化碳溶液;甲醛;α-H取代
文章编号:1005-6629(2024)09-0068-04
中图分类号:G633.8
文献标识码:B
1 问题提出
乙醛作为高中化学醇与羧酸之间重要的桥梁物质,被师生熟知。在高中教学中要求从醛基的角度出发,来探究醛类物质性质,并以此实现对官能团这一概念的学习和深化认识。在教学中对乙醛化学性质进行实验验证时发现,实验室不存在纯乙醛,只有40%的乙醛水溶液,因此产生疑问:如何才能完成乙醛能否使溴的四氯化碳溶液退色这一实验?进而对中学教师中较为普遍的认知——乙醛不能使溴的四氯化碳溶液退色产生怀疑。一些教师认为:乙醛可以使溴水退色,因为溴与水反应生成溴化氢和次溴酸,乙醛与次溴酸反应被氧化成乙酸;由于溴的四氯化碳溶液中不存在氧化剂,无法将乙醛氧化成乙酸,所以乙醛应不能使溴的四氯化碳溶液退色。仔细分析会发现这种认知前后并无因果关系,所以结论不一定正确。
2 相关文献的表述
查阅相关文献发现对于乙醛能否使溴的四氯化碳溶液退色这一问题,范梦怡、刘鹂认为,醛类物质必须要含有能与溴反应的官能团,才能使溴的四氯化碳溶液退色[1]。董顺、肖中荣则直接指出乙醛不能使溴的四氯化碳溶液退色[2,3]。鲁科版教学用书上则表述:乙醛不能使溴的四氯化碳溶液退色[4]。由此可见“乙醛不能使溴的四氯化碳溶液退色”这一认识在重要中学教学期刊,甚至教学参考书中也具有一定的普遍性。
3 实验验证方法
高中实验室无纯乙醛原因为:纯乙醛沸点为20.8℃,极易气化,资料显示乙醛纯度越高越容易出现聚合而生成三聚乙醛,此反应伴随放出大量的热,易引发爆炸,存在危险性。高中实验室不具备保存纯乙醛条件,所以有关乙醛的实验均使用40%的乙醛水溶液来代替纯乙醛。由此导致的问题是:很难获取纯乙醛。笔者曾在冬季气温-20℃,室内16℃,采用蒸馏的方法(自来水冷却,水温11℃)获取到极少量液态乙醛,其挥发速度很快,还未进行除水处理就已完全挥发。而在气温稍高时就无法通过蒸馏(自来水冷却)得到液态乙醛。这就是乙醛能否使溴的四氯化碳溶液退色这一如此简单的问题却难以用实验验证的一个原因。为解决这一难题,我们设计以下两种方案获取无水乙醛,探讨乙醛能否使溴的四氯化碳溶液退色这一问题。
3.1 四氯化碳萃取法
取20mL 40%的乙醛溶液与20mL四氯化碳,在分液漏斗中混合摇匀,静置十分钟,混合液出现分层现象,下层的四氯化碳溶液浑浊,将下层溶液分液后加入已放有20g无水氯化钙的试剂瓶中,盖上塞子,振荡后放置30min。待溶液变澄清取3mL乙醛的四氯化碳溶液于试管中,向其中加入0.5mL溴的四氯化碳溶液,发现溴的颜色在扩散时就开始迅速变浅,15s后完全退去。
为避免可能是氯化钙吸水时间过短,所得溶液中仍含有水,对验证实验造成干扰,更换所得乙醛中干燥剂,再次用无水氯化钙干燥,并放置一天后,重复验证实验,仍能观察到溴的四氯化碳溶液退色。此实验结果说明,无水乙醛可以使溴的四氯化碳溶液退色。
3.2 蒸馏获取干燥液态乙醛法
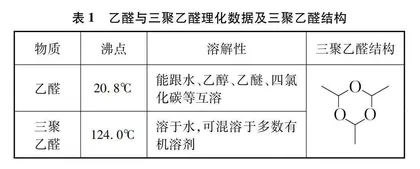
考虑到实验3.1所得乙醛中可能含有三聚乙醛,干扰验证实验,所以再采取蒸馏得到纯乙醛的方法进行实验。乙醛与三聚乙醛的理化数据见表1。
将40%乙醛溶液置于40℃水浴蒸馏(可能是溶液中乙醛与水形成氢键,使沸腾温度变高,温度低于40℃,观察不到溶液沸腾发生),蒸馏出的乙醛先通入装有碱石灰的干燥管,再通入装有无水氯化钙的干燥装置中(如图1),干燥后的乙醛蒸气通入放置于冰盐浴中装有5g无水氯化钙的试管中,为防空气中的水进入,在试管与空气连接部分接一装有无水氯化钙的干燥管。待试管A溶液不再沸腾时关闭开关C、D保留图中虚线框部分并撤去其他装置,为确保乙醛中不含水,放置30min(保持冰盐浴状态,否则室温时乙醛会变为气体)。取一只注射器取掉活栓,向针筒中加入1g无水硫酸铜,安装好活栓,赶出气体,将针头插入试管B橡胶塞,从中吸取2mL乙醛(针头长度不够可以适当倾斜试管,乙醛取用完成后试管重新放置于冰盐浴中),振荡后未发现无水硫酸铜颜色变化。
说明干燥彻底,制备的液态乙醛中不含水。再取一只注射器,针头插入试管B橡胶塞从中吸取0.5mL乙醛,取出后再迅速吸入溴的四氯化碳溶液1mL,用堵头封闭注射器,振荡后发现溶液颜色迅速退去,注射器中有无色气体出现。同时将获取的乙醛更换干燥剂在实验室冰箱-5℃放置一天,重复上述与溴的四氯化碳溶液反应,实验还是得到相同的结果。
为确认反应中未受三聚乙醛的干扰,先在锥形瓶中加盐酸羟胺溶液(50g/L)15mL于冰盐浴中放置10分钟,取0.50mL试管B中所得乙醛加入其中,加两滴溴酚兰作指示剂,用0.5000mol/L氢氧化钠标准溶液来滴定,原理为[5]:
CH3CHO+NH2OH·HCl=====CH3CHNOH+H2O+HCl
HCl+NaOH=====NaCl+H2O
待达到滴定终点后再向试管中加入2.00mL 18mol/L浓硫酸作催化剂,如果体系中残留有三聚乙醛,浓硫酸会使三聚乙醛解聚为乙醛,此时过量的盐酸羟胺会与生成的乙醛反应,产生氯化氢。再用0.5000mol/L氢氧化钠标准溶液来滴定体系中的酸,用第二次滴定所耗氢氧化钠的物质的量减去作催化剂的浓硫酸所耗氢氧化钠的物质的量,即可得出三聚乙醛解聚出的乙醛的物质的量。
实验后发现氢氧化钠用量恰好与用作催化剂的浓硫酸所能消耗的氢氧化钠量相同,说明此乙醛中不含三聚乙醛,实验中通过蒸馏的方法有效地去除了三聚乙醛的干扰。
以上实验说明通过此方法得到纯净的乙醛,而且证明了纯乙醛可以使溴的四氯化碳溶液退色。
4 乙醛使溴的四氯化碳溶液退色机理猜想
乙醛为什么能使溴的四氯化碳溶液退色呢?有以下两种猜想:
猜想1:乙醛发生α-H取代,消耗溴单质。
乙醛分子存在α-H,因为醛基的存在,羰基吸电子诱导效应及α碳氢键超共轭效应使其活性较高,有可能被卤素取代,导致溴的四氯化碳溶液颜色退去。
猜想2:醛基上的羰基与溴加成,导致溴的四氯化碳溶液退色。
由于卤素是一个亲电试剂,因此卤素与羰基加成较难,可能性较小,这也是大多数教师认为溴不可能与乙醛加成而出现退色的原因。
5 乙醛使溴的四氯化碳溶液退色机理验证实验
5.1 用甲醛进行对比验证是否与醛基有关
甲醛与乙醛的区别在于醛基上不存在α-H,如果是猜想1,则甲醛不能使溴的四氯化碳颜色退去。若为猜想2,则应与乙醛与溴的四氯化碳溶液反应现象完全相同。
分别取20mL 35%的甲醛溶液及20mL四氯化碳,在分液漏斗中混合振荡静置十分钟后分液。将下层溶液置于装有20g无水氯化钙的试剂瓶中,放置30分钟。取3mL溶液于试管中,向其中滴加0.5mL溴的四氯化碳溶液,溶液不退色。减少溴的四氯化碳溶液的用量,发现依然不退色。三小时后观察,颜色仍然没有退去。说明不是含有醛基就可以使溴的四氯化碳溶液退色,猜想2不成立。
5.2 对反应后是否有HBr气体产生进行验证
对3.2实验中乙醛与溴的四氯化碳溶液反应时注射器中产生的无色气体检测发现,该气体能使湿润的蓝色石蕊试纸变红,将无色气体导入硝酸银溶液中发现溶液中出现淡黄色沉淀,说明乙醛与溴的四氯化碳溶液反应生成了溴化氢。
对比实验结果说明乙醛使溴的四氯化碳溶液退色原因:发生了α-H溴代,并未发生醛基加成。
6 乙醛α-H取代机理
推断上述猜想1的反应机理(见图2):首先,酸催化下羰基质子化,继而烯醇化,烯醇的π电子向溴单质进攻,形成碳溴键,再失去氧上的质子完成溴化反应[6]。
反应虽然要求酸性条件,但是在邢其毅《有机化学》第四版中对α-H卤化反应中酸催化的表述为:所谓酸催化,通常不加酸,只要反应开始,就产生酸,此酸可自动发生催化反应[7]。反应时先进行一个诱导阶段,乙醛α-H取代开始以后再产生大量的质子就可以使α-H溴代反应顺利进行,实验中没有加酸而直接反应与此原理一致。
化学是基于实验的学科,从以上实验事实可以得出结论:乙醛能使溴的四氯化碳溶液退色。退色原因为发生α-H溴代——其实,在化工生产中用乙醛与氯气直接混合制备一氯乙醛已有相当长的时间[8],说明卤素与乙醛发生α-H取代是很容易的。
参考文献:
[1]范梦怡,刘鹂.聚焦“证据推理与模型认知”:内涵探析及其培育案例——以“葡萄糖”教学为例[J].化学教学,2022,(5):33~39.
[2]董顺.乙醇使溴水褪色的实验探究[J].化学教学,2014,(10):55~56.
[3]肖中荣.四氯化碳在化学实验中的妙用[J].化学教育,2012,33(5):63~64.
[4]王磊主编.普通高中课程标准实验教科书·有机化学基础(选修)教师用书(第4版)[M].济南:山东科学技术出版社,2012:164.
[5]刘敏.提高乙醛收率及纯度的改进方法的研究[D].长春:吉林大学硕士学位论文,2016.
[6][7]邢其毅,裴伟伟,徐瑞秋,裴坚.基础有机化学(第4版)[M].北京:北京大学出版社,2016:480.
[8]梁诚.一氯乙醛生产与应用[J].中国氯碱,2000,(8):34~35.