培养化学定量思维的实验教学设计
作者: 刘林青 李卓
摘 要: 化学定量思维是指运用定量的方式和方法分析和解决化学问题的思考过程,在化学学习中发挥着重要作用。梳理化学定量思维的内涵与培养路径,设计“探秘Fe(NO3)3溶液中微粒的氧化性”教学课例。从探究Fe(NO3)3溶液中微粒的氧化性入手,分别从横向物质的氧化性和纵向物质的浓度进行对照,层层递进,深入挖掘实验中的定量功能,有利于学生化学定量思维的发展。
关键词: 高中化学; 实验教学; 定量思维; 硝酸铁
文章编号: 10056629(2024)10004804
中图分类号: G633.8
文献标识码: B
《普通高中化学课程标准(2017年版2020年修订)》强调了定量研究、定量意识、定量分析、定量实验、定量计算在化学学习中的重要性[1]。通过掌握这些定量方法,学生能够更深入地分析化学变化,准确地理解关键知识点,并提高他们在实验探究中的分析能力和解决问题能力。然而,学生的化学定量思维现状不容乐观,一项对107名高二学生的调查显示,了解“定量”和“定性”的差别的学生仅占27%,大部分学生对“定量”仅有模糊的认识,没有准确的认知;甚至只有55%的学生同意任何化学现象或事实背后都存在数量关系,这表明相当一部分学生不了解化学实验的本质规律以及“定量”的重要性[2]。鉴于此,本研究尝试从理论和实践两个方面对化学定量思维的培养进行探索。首先,在理论层面上梳理化学定量思维的概念内涵和培养方法。其次,结合高中化学内容设计实验教学,希望能为相关教学实践提供一些参考。
1 化学定量思维:是什么,怎么培养
化学描述可以分为定性和定量两种类型。前者是对物质性质进行定性描述,如某溶液呈酸性;而定量描述是在定性基础上对事物进行深化的、精确的表达,通过数量关系来揭示事物的本质,如该溶液的pH为2。同质不同量的化学物质在规模和发展程度上有所不同,这就可能会造成化学变化现象和结果的不同。因此只有进行定量描述,才能够更深入地理解和把握化学现象的本质,揭示不同量变引起的现象和结果的差异。
化学定量思维是指运用定量的方式和方法分析和解决化学问题的思考过程。化学定量思维能使研究者更加理性和透彻地思考化学问题。化学定量思维作为一种重要的思维方式,在化学领域中发挥着重要作用。一方面表现为定量的研究方法是化学发展为一门独立学科的重要标志之一,能够推动化学研究向更加精确和准确的方向发展[3]。另一方面,化学定量思维能帮助学生深入理解化学变化背后的本质,从而促进对化学问题的更深入的思考和理性分析[4]。
在中学阶段,化学定量思维的学习内容以物质的量和质量为核心,以质量守恒定律为依据,结合化学基本概念原理和元素化合物知识而展开。教材从初中阶段以质量为核心到高中阶段以物质的量为核心,从核心概念到基础计算再到综合计算,遵循从宏观到微观、从简单到复杂的认知过程,构建从核心概念到基础计算再到综合计算的递进式体系,让学生逐步学会从量的角度认识物质的组成、结构和变化规律,体会定量方法对化学学习和研究的重要意义[5]。
实验教学是发展学生化学定量思维的重要途径,而传统的中学化学实验比较侧重定性描述,对定量方面的重视程度不够。为了培养学生的化学定量思维能力,在实验教学中可以从以下两个方向入手。首先,在传统的定性实验中挖掘其定量功能,引导学生在观察和记录实验现象时注重数量关系,以及通过实验数据进行量化分析。其次,教师在认知、操作和评估方面要强调“定量”,使学生意识到定量思维的重要性,并能灵活运用定量方法解决化学问题[6]。总之,需要为学生提供一个有利于培养定量思维的学习平台,让学生在实践活动中发现“定量”在实验研究和学科本质中的重要性,从而主动构建定量概念,逐渐形成定量的科学思维和习惯。
以下尝试设计注重定量思维发展的化学实验教学,帮助学生形成化学定量观念,提升学生理解和运用定量思维方法解决化学问题的能力。
2 实验教学设计——以“探秘Fe(NO3)3溶液中微粒的氧化性”为例
2.1 教材和学情分析
“探秘Fe(NO3)3溶液中微粒的氧化性”是沪科版高中化学必修一第二章“海洋中的卤素资源”第二节“氧化还原反应和离子反应”中拓展课的内容。本节课分别从定性和定量两个角度比较Fe(NO3)3溶液中粒子的氧化性,层层递进、不断深化,促进学生定量思维的发展。实验围绕以下三个活动开展教学:(1)Fe(NO3)3溶液中的氧化性微粒验证(定性确定氧化性微粒,为定量分析做好铺垫);(2)某一浓度下Fe(NO3)3溶液中微粒的氧化性比较(引入量化内容,从量化角度认识氧化剂和还原剂的性质);(3)Fe(NO3)3溶液中微粒在不同条件下氧化性强弱的变化(使用数据进行分析和解释不同的量化条件下的微粒氧化性)。通过实验方案设计、方案评价、实验现象分析等多个环节培养学生的定量思维与研究能力。
学生在初中和高一上学期已部分接触过探究实验,初步熟悉实验的探究流程,具备提出问题、做出假设和实验操作等基本能力。通过质量守恒定律、化学方程式的学习,已熟悉“过量”“少量”“适量”“一定量”等术语,知晓任何化学反应的背后存在着数量关系,形成了初步的定量意识。基本具备氧化还原反应的判断、离子反应的书写、元素化合物基本性质等理论基础知识。
2.2 教学目标与重、难点
教学目标:学习并应用“控制变量法”从定性和定量两个角度设计实验,定量分析、理解Fe(NO3)3相关反应中氧化剂和还原剂的性质,掌握如何通过定量实验得出可靠的科学结论。通过定量实验,深入理解不同条件下Fe(NO3)3溶液中各微粒的氧化性,并能使用数据进行分析和解释,发展化学定量思维。以“Fe(NO3)3的氧化性探究”为例,学习分析复杂氧化剂和还原剂性质的方法,能够将复杂问题简单化,并在此基础上进行定量分析。
教学重点:理解Fe(NO3)3溶液氧化性的成因;探究0.1mol/L的Fe(NO3)3溶液中起氧化作用的微粒。
教学难点:用控制变量法设计探究实验;验证不同浓度、不同酸性条件下Fe(NO3)3溶液中各微粒氧化性的强弱。
2.3 教学流程
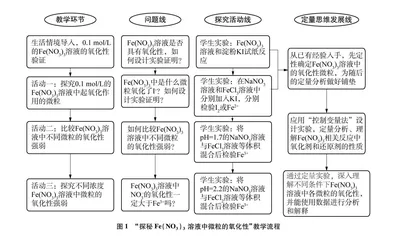
教学流程设计如图1所示。
2.4 教学环节
2.4.1 情境导入:验证0.1mol/L的Fe(NO3)3溶液的氧化性
[教师]展示0.1mol/L的Fe(NO3)3溶液和Fe(NO3)3溶液用于铜蚀、铜雕的作品,引导学生预测Fe(NO3)3的化学性质。
[教师]Fe(NO3)3是否具有氧化性呢?请用桌上的仪器与药品验证自己的猜想。
[学生]向淀粉KI试纸上滴加0.1mol/L的Fe(NO3)3溶液,观察实验现象。
[现象]淀粉KI试纸变蓝。
[教师]这说明什么呢?
[学生]I-被Fe(NO3)3溶液氧化生成I2,说明溶液具有氧化性。
设计意图:
创设情境,联系生活,激发学生对Fe(NO3)3学习的兴趣。以Fe(NO3)3和Cu的反应为例,加之实验验证,从定性角度加深对Fe(NO3)3溶液氧化性的认识。
2.4.2 活动一:探究0.1mol/L的Fe(NO3)3溶液中起氧化作用的微粒
[教师]氧化I-的可能是Fe(NO3)3溶液中的哪些微粒呢?
[学生]可能有以下情况:①NO-3在酸性条件下氧化I-;②Fe3+氧化I-;③二者都可以氧化I-。
[教师]请设计并进行实验以验证猜想。给出信息提示:NO-3在不同条件下的还原产物较复杂,难以观察到气体产生;0.1mol/L的Fe(NO3)3溶液的pH约为1.7。
[学生]用0.3mol/L NaNO3溶液加盐酸调节pH至1.7代替0.1mol/L的Fe(NO3)3溶液进行试验,淀粉碘化钾试纸变蓝。证明假设①成立,即NO-3在酸性条件下氧化I-。
[学生]用0.1mol/L的FeCl3代替0.1mol/L的Fe(NO3)3溶液进行试验,淀粉碘化钾试纸变蓝。证明假设③成立,即NO-3在酸性条件下、Fe3+二者都可以氧化I-。
设计意图:
通过实验探究活动,在Fe(NO3)3溶液具有氧化性的基础上,进一步明确对Fe(NO3)3溶液中NO-3和Fe3+的氧化性的定性认识,为随后量化分析微粒的氧化性强弱做好铺垫。
2.4.3 活动二:比较0.1mol/L的Fe(NO3)3溶液中各微粒的氧化性强弱
[教师]大家通过实验证明了0.1mol/L的Fe(NO3)3溶液中NO-3在酸性条件下和Fe3+都能起氧化作用,但是它们的氧化性谁更强一些呢?如何去检验谁的氧化性更强?
[学生]由于氧化剂的氧化性强于氧化产物,因此如果可以在0.1mol/L的Fe(NO3)3溶液中,观察到NO-3氧化Fe2+的现象,那么就可以说明在0.1mol/L的Fe(NO3)3溶液中,NO-3的氧化性强于Fe3+。
[教师]非常好,请同学们设计实验,用桌上的仪器和试剂探究0.1mol/L的Fe(NO3)3溶液中不同氧化剂粒子的氧化性的强弱,要注意反应物的用量。
[学生]在0.6mol/L的NaNO3溶液中加入盐酸调节pH至1.7,在0.2mol/L的FeCl2溶液中加盐酸调节pH至1.7。取两种溶液各1mL混合,使之充分反应,加入适量硫氰化钾溶液,摇匀,观察现象。
[教师]大家观察到什么现象,这说明了什么?
[学生]溶液变为血红色,说明有Fe3+出现。因此在pH=1.7时,0.3mol/L的NO-3能氧化0.1mol/L的Fe2+。即在0.1mol/L的Fe(NO3)3溶液中,NO-3的氧化性强于Fe3+。
设计意图:
在找到Fe(NO3)3溶液中起氧化作用的物质后,应用“控制变量法”设计实验,在定量分析中比较NO-3和Fe3+氧化性的强弱。
2.4.4 活动三:比较不同浓度下Fe(NO3)3溶液中氧化剂的氧化性强弱
[教师]通过实验,我们发现在0.1mol/L的Fe(NO3)3溶液中,NO-3的氧化性强于Fe3+,但是我们知道,物质在不同条件下可能呈现出不同的性质。是否在其他浓度下的Fe(NO3)3溶液中NO-3的氧化性还是强于Fe3+呢?请同学们思考并设计实验,比较在0.005mol/L的Fe(NO3)3溶液中,NO-3与Fe3+氧化性的强弱。
[教师]给出信息提示:0.005mol/L的Fe(NO3)3溶液的pH约为2.2。
[学生]设计并进行实验:首先向0.03mol/L的NaNO3溶液中加入盐酸调节pH=2.2,向0.01mol/L的FeCl2溶液中加入盐酸调节pH=2.2。取1mL该FeCl2溶液于试管,向其中加入适量硫氰化钾溶液,再加入1mL调节好pH的NaNO3溶液,摇匀,观察现象。
[教师]大家观察到什么现象,这说明什么呢?
[学生]试管中无血红色出现,表示无Fe3+生成。即在0.005mol/L的Fe(NO3)3溶液中,NO-3的氧化性不强于Fe3+。
[拓展深化]通过实验,同学们发现Fe(NO3)3溶液中的硝酸根离子和铁离子在不同条件下氧化性强弱有所不同。正如前文中所说的,Fe(NO3)3可以用于铜的浸蚀、雕刻和抛光,实践表明在Fe(NO3)3溶液浓度为0.05mol/L时,抛光效果最好,那么此浓度的Fe(NO3)3溶液中,起主要氧化作用的是哪种微粒呢?请同学们带着这个问题,在课后设计并完成实验,对0.05mol/L的Fe(NO3)3溶液中微粒的氧化性强弱做一个比较。