稀硫酸与大理石颗粒反应制取CO2的实验探究
作者: 邢蓓蓓 杜华伟 孟庆华
摘 要: 常规条件下一般不能用硫酸与大理石反应制备CO2,采用压力传感器探究了多种条件下稀硫酸与大理石的反应过程,发现溶液在充分搅拌的条件下,适当降低硫酸溶液的浓度,是可以用硫酸与大理石反应制备CO2的。获得的优化条件是搅拌速度10档(1250r/min)、硫酸浓度0.1mol/L用量15mL、细颗粒(15粒/克)大理石用量为15g,制备的CO2可成功用于蜡烛熄灭的性质实验。
关键词: 二氧化碳制备; 硫酸; 大理石; 实验探究
文章编号: 10056629(2024)10008205
中图分类号: G633.8
文献标识码: B
1 问题提出
“二氧化碳的实验室制取与性质实验”是《义务教育化学课程标准(2022年版)》学习主题一“科学探究与化学实验”要求必做实验之一[1]。实验室制取CO2时,原料一般采用盐酸和大理石(或石灰石),而不用硫酸和大理石,有学者还借助于二氧化碳传感器等数字化实验证明了硫酸与大理石反应不能制取CO2[2,3]。当采用盐酸与大理石反应制取CO2时,由于盐酸的挥发性,导致制取的CO2中含有一定量的HCl气体,会影响后续CO2的一些性质实验[4]。那么能否通过适当改变实验条件,用稀硫酸与大理石反应制取CO2呢?本文通过压力传感器探究了多种条件下稀硫酸与大理石的反应过程,结果发现,适当降低硫酸浓度并增加溶液容量,采用小颗粒大理石并增加其用量,在溶液充分搅拌的条件下是可以用大理石和稀硫酸在实验室制取CO2的。
2 实验原理
大理石中的碳酸钙与硫酸反应生成微溶硫酸钙,通常情况下硫酸钙会沉积在大理石表面形成一层硫酸钙膜,阻止硫酸与大理石中的碳酸钙继续反应,导致人们认为大理石不能与硫酸反应制取二氧化碳。深入思考发现,只要破坏形成硫酸钙膜的条件,硫酸与大理石中的碳酸钙就会继续反应,就能用大理石与硫酸反应制取二氧化碳。根据沉淀生成原理,SO2-4浓度与Ca2+浓度乘积大于CaSO4的Ksp才能生成CaSO4沉淀,硫酸钙是微溶性硫酸盐,其20℃时的溶度积(Ksp)为2.0×10-4[5],适当降低硫酸浓度并增加溶液的用量,使在CO2制取期间难以生成硫酸钙沉淀,即硫酸钙膜。为了进一步破坏硫酸钙膜的形成,大理石与硫酸反应过程中需对溶液进行充分搅拌,并采用小颗粒大理石且适当增加其用量。
3 实验装置
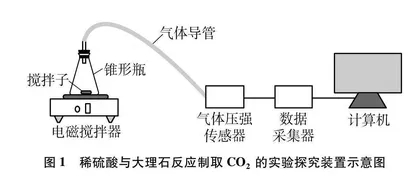
稀硫酸与大理石反应制取CO2的实验探究装置如图1所示。开动电磁搅拌器对锥形瓶中的硫酸溶液进行搅拌,减缓硫酸钙沉积形成膜层,使硫酸与大理石中碳酸钙持续反应生成CO2;锥形瓶口用带玻璃导管的橡胶塞塞紧,生成的CO2气体通过导管被压力传感器检测转换成电信号;数据采集器将传感器转换的电信号放大成数字信号传送到计算机存储,并以图像形式直观显示出来。
4 仪器和药品试剂
4.1 仪器
威尼尔(Vernier)GPSBTA气体压强传感器、威尼尔(Vernier)LabQuest Mini型数据收集器、数据采集软件(Logger Pro 3.14.1)、威尼尔(Vernier)STIR电磁搅拌器、125mL磨口锥形瓶、25mL量筒、250mL烧杯、250mL磨口集气瓶
4.2 药品试剂
浓硫酸(分析纯)、浓盐酸(分析纯)、纯净水、大理石颗粒(将废弃的装修用大理石板粉碎成粗、中、细颗粒,对应粒度分别为2粒/克、5粒/克、15粒/克)、小蜡烛
溶液的配制:5.0mol/L HCl溶液储备液;5.0mol/L H2SO4溶液储备液;不同浓度的各种溶液可分别用上述储配液用纯净水稀释获得
5 实验部分
5.1 实验探究步骤
按图1所示装配好实验探究装置,实验操作步骤如下:(1)打开计算机电源,启动计算机后运行数据采集软件;(2)检查装置气密性,用手紧握锥形瓶,若观察“数据采集软件”界面显示的气体压强数字增大、松手后气体压强数字减小表明装置气密性良好;(3)按实验要求设置数据采集参数及图像显示参数;(4)将一定粒度大小和质量的大理石颗粒放入锥形瓶中,并放入一颗电磁搅拌子,打开电磁搅拌器电源开关,视实验要求设置一定的搅拌速度,加入一定体积的硫酸或盐酸溶液后,立即塞紧橡胶塞并点击“数据采集软件”界面数据“采集”按钮,采集气体压力随时间的变化数据;(5)数据采集结束后,处理、保存数据。
5.2 CO2制备与性质实验
用硫酸和大理石作原料,在最优的实验条件下采用图2所示的装置制取CO2,集气瓶收集满CO2后用玻璃片盖住瓶口待用。把两支短蜡烛按图3所示固定在烧杯内,点燃,拿起上述收集满CO2的集气瓶,向烧杯内缓慢倾倒CO2,观察蜡烛1、2燃烧情况。
6 实验结果与讨论
6.1 硫酸钙膜形成对酸与大理石反应生成CO2的影响
硫酸与大理石反应生成的碳酸钙膜会阻止硫酸继续与大理石中碳酸钙反应,图4中曲线4是10mL 0.25mol/L H2SO4与5g粗大理石(2粒/克)颗粒反应的压强时间曲线,可以看出在120秒内,压强几乎没有变化,说明确实形成硫酸钙膜阻止了反应的进行,故教材上不选用硫酸与大理石反应制取CO2气体是有道理的;图4中曲线3是0.25mol/L H2SO4与5g粗大理石(2粒/克)颗粒反应120秒后将硫酸溶液倒出,再向锥形瓶中加入10mL 0.5mol/L盐酸后的压强时间曲线,可以看出前50秒盐酸与大理石中碳酸钙几乎没有反应,而50秒后压强逐渐变大,说明硫酸钙膜逐渐破裂,盐酸逐渐与裸露的大理石颗粒表面的碳酸钙反应生成CO2气体;将0.25mol/L H2SO4与5g粗大理石(2粒/克)颗粒反应120秒后将硫酸溶液倒出,加适量纯净水震荡,目的是清洗除去大理石表面的硫酸钙膜,反复清洗三次后加入10mL 0.5mol/L盐酸后反应的压强时间曲线如图4中曲线2所示,可以看出从一开始盐酸就能与大理石表面的碳酸钙反应,尽管没有图4中曲线1(0.5mol/L盐酸直接与粗大理石(2粒/克)颗粒反应的压强时间曲线)反应剧烈,至少说明当H2SO4与5g大理石反应过程中振荡或搅拌溶液能够减少硫酸钙膜在大理石表面的覆盖率,使反应能够持续进行。
6.2 搅拌速率对硫酸与大理石反应生成CO2的影响
根据6.1实验结论,有必要考察搅拌速率对H2SO4与大理石反应过程的影响。图5是不同搅拌速率下0.25mol/L硫酸与5g粗大理石颗粒(2粒/克)反应的压强时间曲线。图中结果表明不同搅拌速率下在同一反应时间内锥形瓶内随着搅拌速率加快压强变大,说明生成CO2的气体多,也就是说搅拌速率越快,硫酸钙膜越难以形成,大理石表面裸露的面积越大,有更多的大的碳酸钙与硫酸反应,因此后续研究采用电磁搅拌器最快的搅拌速率10档(125r/min)搅拌溶液。
6.3 相同搅拌情况下硫酸浓度对硫酸与大理石反应生成CO2的影响
硫酸钙膜的形成与硫酸浓度紧密相关,也需要考察硫酸浓度对硫酸与大理石反应过程的影响。图6是搅拌速率1250r/min条件下不同浓度硫酸与5g粗大理石颗粒(2粒/克)反应的压强时间曲线,图中结果表明相同的搅拌速率下在同一反应时间内锥形瓶内随着硫酸浓度的减小压强变大,说明较低的硫酸浓度下不易形成硫酸钙膜,有利于反应的持续进行,后续的研究则采用搅拌速率10档(125r/min)、硫酸浓度为0.1mol/L。
6.4 相同搅拌情况下大理石用量对硫酸与大理石反应生成CO2的影响
其他条件相同时,大理石用量不同,生成的气体的量也不同。图7是在搅拌速率10档(1250r/min)、硫酸浓度0.1mol/L用量10mL条件下,不同用量的粗大理石颗粒(2粒/克)与0.1mol/L硫酸反应的压强时间曲线。比较图7中三种不同用量的粗大理石颗粒(2粒/克)的压强时间曲线,显示粗大理石颗粒(2粒/克)用量较多时,生成CO2的气体就越多,因此后续的研究中大理石用量采用15g。
6.5 相同搅拌情况下大理石粒度不同对硫酸与大理石反应生成CO2的影响
其他条件相同时,大理石颗粒的粒度不同,产生的气体量也不同。图8是在搅拌速率10档(1250r/min时)条件下15g粒度不同的大理石颗粒与浓度为0.1mol/L用量为10mL硫酸反应的压强时间曲线,结果显示其他条件相同情况下,颗粒越小,大理石颗粒总面积越大,会有更多的碳酸钙参与反应,考虑到制备小颗粒大理石的难度,后续研究采用的大理石粒度为每克大理石15粒为宜。
6.6 相同搅拌情况下硫酸溶液用量对硫酸与大理石反应生成CO2的影响
图1所示的探究装置中,锥形瓶至压力传感器是密封的,生成的CO2气体愈多,锥形瓶内压强愈大,因此硫酸与大理石反应越快,单位时间内产生的CO2气体也愈多,压强随时间增大也越快,所得的硫酸与大理石反应的压强时间曲线越陡峭。观察前述各种条件下硫酸与大理石反应的压强时间曲线,发现前期曲线比较陡峭,表明单位时间内生成CO2气体较多,后续阶段曲线变化比较缓慢,说明后期反应比较慢,单位时间生成CO2气体的比较少,主要原因是前述研究仅增加了大理石用量,硫酸用量为10mL没有改变,导致随着时间的延长参与反应的硫酸量变少了,生成的硫酸钙量增加了,大理石表面部分被硫酸钙膜覆盖,硫酸与大理石反应单位时间内生成的CO2气体变少了,因此应该加大硫酸溶液的用量,这样一是增加可反应的硫酸的量,二是溶液体积增大了,溶液中可溶性硫酸钙量也会增加,降低了大理石表面被硫酸钙膜覆盖的面积。由于硫酸溶液体积超过15mL、反应时间超过50秒后,锥形瓶内压力过大(压强大于130kPa,密封锥形瓶的橡胶活塞就崩开了),故只研究硫酸用量为10mL和15mL两种情况。图9是在搅拌速率10档(1250r/min)、硫酸浓度0.1mol/L、细颗粒大理石(15粒/克)用量为15g条件下获得的,实验结果表明硫酸用量增加,能保持后续阶段反应速度较快的速度进行。
6.7 优化条件下硫酸与大理石反应制备与CO2性质实验
根据前述实验结果可以确定制备CO2的最优条件:搅拌速度10档(1250r/min)、硫酸浓度0.1mol/L用量20mL、细颗粒大理石(15粒/克)用量为15g,采用图2、图3装置和方法进行实验,烧杯中的蜡烛1、2依次熄灭。
7 结语
综上所述,充分搅拌溶液(搅拌速率1250r/min)、适当降低硫酸浓度(0.1mol/L),能够破坏反应体系中硫酸钙膜的形成条件,使硫酸能与大理石中的碳酸钙持续反应生成CO2,若再适当增加硫酸溶液的用量(20mL),并降低大理石颗粒的大小(粒度15粒/克用量15克)就能够用硫酸和大理石制备CO2用于CO2的性质实验。
参考文献:
[1]中华人民共和国教育部制定. 义务教育化学课程标准(2022年版)[S]. 北京: 北京师范大学出版社, 2022: 15.
[2]陈俏. 运用CO2传感器研究CaCO3与盐酸和硫酸的反应[J]. 化学教与学, 2012, (3): 93.
[3]朱青. 基于模型认知素养的翻转课堂教学研究[J]. 福建教育学院学报, 2022, (8): 39~41.
[4]盛俭发, 徐泓, 郑军. 二氧化碳制备中对盐酸挥发性的监测[J]. 化学教学, 2018, (8): 66~68.
[5]杨德任. 中学教学全书(化学卷)[M]. 上海: 上海教育出版社, 1996: 898.