基于“物质研究模型”开展课堂即时性评价的教学实践
作者: 缪宇 孙应伦
摘要: 以“氧化钠和过氧化钠”的教学为例,围绕“物质研究模型”进行课堂即时性评价的教学设计。从核心素养的维度、角度、水平等方面开展评价任务,探讨如何在高中化学教学过程中实施课堂即时性评价,落实“教学评”一体化,有效提升教学质量,落实立德树人的根本任务。
关键词: 中学化学; 课堂评价; 即时性评价; 物质研究模型
文章编号: 10056629(2023)07003106
中图分类号: G633.8
文献标识码: B
1 问题的提出
课堂即时性评价是指在教学活动过程中,对于学生的行为表现给予及时鼓励、调控及引导的评价活动,一般依托学习任务中的师生互动实现,形式包括教师点评、学生互评、学生点评、学生自评等。其中“教师提问、学生回答或实践”是常见的一种方式,例如学生在完成学习任务的各项问题后进行作答,教师根据学生的表述对其学习态度、方法、过程、效果等方面进行评价,这是“化学课堂教学评价中一种重要的评价方式”[1]。课堂即时性评价是一种直接、快捷、行之有效的评价方法,其价值主要体现在诊断、反思、推进教学等方面[2],促进学生思维的纵向发展,有利于学生获取知识、坚定学习动机、提升学习品质,培养学科核心素养。
在教学实践中发现,不少教师缺少有效的课堂即时性评价,原因主要有以下两个方面:一是教师对学科核心素养的理解不充分,例如对化学模型的内容和素养水平表现认识模糊,导致教学设计缺少明确、有效的评价目标;二是教师设计的学习任务与学生现有的认知水平不匹配,学生缺少表现机会,导致课堂上难以开展教师评价、学生互评、学生自评等活动。此外受教师风格、学生个性、班级氛围、知识难度、问题有效性等因素的影响,即时性评价的价值往往发挥不足。
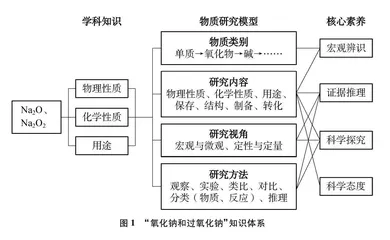
“物质研究模型”由物质类别、研究内容、研究视角、研究方法构成,是研究物质的一般思路,运用该模型能学习氯、硫、氮等元素的常见无机物的共性知识,便于突出个性知识的学习。本文以人教版普通高中教科书《化学·必修(第一册)》(2019年6月第一版)第二章第一节第2课时“氧化钠和过氧化钠”的教学为例,从分析教学内容的模型本体及功能、评价策略出发,设计基于“物质研究模型”建构过程的学习任务,呈现“发现物质研究内容和研究方法”“应用物质研究模型”“完善物质研究模型”三个环节的教学实录。最后对学生的表现和任务完成情况进行反思,提出开展课堂即时性评价的四个要点,尝试探讨在高中化学教学过程中实施课堂即时性评价的有效路径,落实“教学评”一体化和提升教学质量。
2 开展课堂即时性评价的教学设计
2.1 教学内容分析
《普通高中化学课程标准(2017年版2020年修订)》(以下简称“课标”)对“氧化钠和过氧化钠”这一课时的内容要求是“结合真实情境中的应用实例或通过实验探究,了解Na2O和Na2O2的主要性质及其在生产、生活中的运用”;在素养上达到熟练辨识物质性质和正确表征的程度,并用科学的方法研究物质,根据目的设计探究实验方案并完成实验;在实践过程中培养探究兴趣和科学态度,积极以合作交流的方式对实验现象、结论进行分析[3]。
本章的教学流程是建立物质研究模型(钠及其化合物)→应用模型(氯及其化合物)→完善模型的定量研究视角(物质的量)。本课时教学目标重点是利用模型建构达到认识物质研究模型的水平,课时知识体系如图1所示。
2.2 学情分析
通过第1课时“活泼的金属单质——钠”的学习,学生接触了物质研究的模型,但还没有进行具体的应用,需要用学习任务的形式,抽象出该模型并充分加以应用。本阶段的学生已有分类法、碱性氧化物、氧化还原反应等学科知识储备,也有运用POE策略探究物质性质的经历。
2.3 目标设计
“教学评”一体化教学是一个有机整体,要发挥即时性评价的诊断与发展功能,就要注重教学目标与评价目标、学习任务和评价任务的一致性。
本课时涉及的主题是“化学科学与实验探究”和“常见的无机物及其应用”,依据“课标”的学业要求,并结合“物质研究模型”的建构过程,将学业要求整合为四个教学目标(见表1)[4]。
“学业要求”是知识和技能层面的诊断,要实现素养为本的“教、学、评”一体化教学,还应当结合化学学科核心素养水平进行诊断。姜建文就化学学科核心素养从“维度、角度、水平”三个要素进行了详细阐述[5],开发了“评价目标设计路径”。本课时以此为依据,将教学目标与素养水平相匹配,设计了对应的四个评价目标(表1),具备诊断和发展素养的功能,是开展即时性评价的依据。
2.4 任务设计
本课时以“钠的性质学习”为起点,让学生经历发现物质的研究内容,形成研究物质的方法。围绕“Na2O和Na2O2的性质”学习,设计了五个子任务:对比性质差异、预测Na2O2化学性质、揭秘“滴水生火、吹气生火”原理、形成化学观念(元素观、微粒观)、归纳研究物质的一般方法。帮助学生建构物质研究模型,并能选取适当的方法研究认识新物质,在“认识Na2O2”的过程中实现“物质研究模型”的应用,最后从“药品保存、物质结构、物质制备”等方面完善物质研究模型。让学生感受由特殊到一般的哲学思想与化学学科学习融合的过程,体会发现和认识物质的螺旋式上升的认知历程。
本课时的任务结构如图2所示。
3 实施教学
教学过程中,学习任务由凸显思维过程的问题来驱动,问题可由教师或学生提出,其目的是指导学生展开具体的学习活动,方便教师组织开展评价任务。
3.1 任务一:发现物质的研究内容、研究方法
同学们从哪些方面了解了金属钠?是通过哪些方法知道这些知识的?
[教师]演示“钠的燃烧”实验,布置任务,根据学生回答提示未答出的研究内容。
[学生]不同学生分别回答出“物理性质、化学性质、保存方法”,经提示后回答“用途”,自评认识有遗漏。多数学生采用了观察法和实验法,部分学生相互回忆上一课时的经历。
[教师]肯定学生知道常见物质的研究内容,用钠举例补充物质结构、制备等认识角度。诊断后发现学生对观察法和实验法比较熟悉。从孤立水平小结研究模型,包括研究内容和研究方法。
设计意图:通过回顾梳理有关钠的性质的学习方法,让学生发现研究物质的方法存在相似性,并提炼出认识研究物质的方法模型,为学习Na2O和Na2O2的性质提供方法参考。
3.2 任务二:应用物质研究模型认识Na2O、 Na2O2
子任务1:独立完成课本第35页“思考与讨论”。同桌讨论:根据研究内容和研究方法,你知道了哪些知识?
[教师]布置独立思考题,随机抽一名学生上黑板书写。发现学生普遍能描述Na2O、 Na2O2的物理性质,但不能独立写出Na2O与盐酸、CO2反应的化学方程式,随后提示Na2O与CaO性质相似,均属于碱性氧化物,能发生反应CaO+H2OCa(OH)2、 CaO+2HClCaCl2+H2O、 CaO+CO2CaCO3,组织讨论并描述Na2O的化学性质。
[学生]经过提示后能描述碱性氧化物的定义,随后正确描述Na2O的化学性质,能在互评中写出化学方程式,指出易错的化学式和配平,讨论类比法的含义。
[教师]点评学生运用观察法分析物理性质的掌握情况,分析学生无法正确书写反应的方程式的原因,并让完成任务的学生分享他们对“碱性氧化物”定义的理解。
设计意图:该任务是用观察法、类比法研究Na2O的物理性质、化学性质,可根据学生表现调整评价方式,引导学生发现研究方法与研究内容之间的紧密关联。
子任务2:预测Na2O2的化学性质。
[教师]演示“滴水生火”实验,让学生辅助完成“吹气生火”实验,组织学生讨论、发言、互评。
[学生]对现象感到惊讶,随后分组讨论:为什么脱脂棉会燃烧?判断依据是什么?
[学生1]是Na2O2易燃。
[学生2](抢答)不对,是脱脂棉燃烧。
[教师]燃烧的条件有哪些?目前具备什么条件?
[学生2]根据燃烧的条件,温度要达到可燃物的着火点。两个实验中Na2O2应该是发生了化学反应,放出热量使脱脂棉燃烧。
[教师点评]学生2的预测依据是燃烧的条件,为什么能“吹气生火”呢?
[学生3]可能是Na2O2与CO2反应放热。
[教师]呼出气体中有大量的CO2, CO2是不可燃的,为什么脱脂棉还能烧起来?
[学生4]空气中有O2。
[学生5]还有可能是Na2O2与CO2反应产生了O2。
[教师]学生4的猜想也是可能的,请从化合价变化角度思考为什么反应可能产生氧气?
[学生5]Na2O2中氧为-1价,有可能发生氧化反应变成0价的单质。
[教师点评]在探讨过程中,同学们能从宏观现象中找出关键信息,并且联系燃烧条件预测产物,用Na2O2中氧的价态并结合氧化还原反应的原理进行推测,个别没发言的同学还类比Na2O猜想Na2O2的化学性质,但Na2O2与Na2O的化学性质是否相似还需要实验验证,接下来就先要设计实验。
设计意图:脱脂棉燃烧的原因分析还算比较简单,难点在于为什么要做这样的猜想。该任务能将根据经验分析提升到运用概念进行推理,并把对物质的认识提升到元素层面。此外,学生经过难度略微增大的讨论后得出猜想,设计并完成实验的动机非常强烈,能顺利推进课堂教学。
子任务3:探究Na2O2与水反应。分组设计并完成实验,验证猜想。
[教师]组织学生分组讨论实验目的、实验操作、预测现象和结论。讨论完后汇报方案。
[学生]小组内讨论后由代表进行发言。
[教师点评]各组汇报的实验方案要素完整,经过集思广益能提出不同的验证方法,而且对预测和结论的表述更加有条理。接下来完成实验,操作时须注意使用方法和操作安全。
[学生]学生分工进行实验操作、记录现象、用平板拍照,合作完成实验。个别小组提出疑问:为什么木条没有复燃、为什么会观察到酚酞退色?
[教师]观察学生合作的表现,并参与学生讨论,引导学生解决实验中的小问题,鼓励学生进行反思性自评。
[教师点评]最终大家都顺利完成了实验,得出了Na2O2与水反应放热、生成O2与NaOH的结论。部分小组观察到了异常的酚酞退色的现象,有一个组反复做了实验也退色,有的组第二次实验才退色,这说明不是操作上的错误,而是存在一定的原因的。本节课先利用Na2O2的性质分析一下,原因课后再进行解释。
设计意图:该实验属于定性的验证实验,操作比较简便,很适合高一学生。师生互动更直接和具有针对性,学生互评容易开展,但教师需要控制时间。分析“酚酞退色”这一反常现象的原因需要结合氧化还原原理和化合物结构知识并用实验验证等,适合作为课后任务进行探究。
子任务4:发展从元素水平到微粒水平的认识进阶。独立思考:以上实验说明Na2O2具有什么化学性质?请用化学方程式表示。为什么同样是钠的氧化物,Na2O与Na2O2的化学性质差异如此之大?
[教师]布置任务,查看学生书写化学方程式和分析过程。
[学生]学生完成任务情况差异较大。多数学生能写出化学方程式的各物质但配平有一定困难;少数学生能想到用双线桥来分析反应;个别学生还能发现反应是歧化反应,能指明Na2O与Na2O2的化学性质差异大是因为氧的价态不同,并准确说出反应时转移的电子数。
[教师点评]讲授转移电子数的分析过程。化学反应可分为氧化还原反应和非氧化还原反应,高中阶段要学会从这个角度分析,而且要将宏观和微观结合起来。从宏观上看,过氧化钠在反应中既表现出氧化性又表现出还原性;从微观上看,分析反应转移的电子数,双线桥是一种很好的表征方式。