大概念统领下的单元教学整体设计与实践
作者: 李学玲 杨玉琴 孙玉明 辛欣
摘要: 以“高铁建设中的金属和金属材料”为大情境进行“物质的多样性”大概念统领下的单元教学整体设计,系统呈现了基于课标要求和教材二次开发的单元架构、单元教学目标的确定、学情的利用策略、情境任务活动一体化的教学过程、单元知识整体结构及学习评价等,为单元教学提供可借鉴课例。
关键词: 大概念统领; 单元教学整体设计; 金属和金属材料
文章编号: 10056629(2023)07004409
中图分类号: G633.8
文献标识码: B
《义务教育化学课程标准(2022年版)》(以下简称“2022版课标”)构建了大概念统领的化学课程内容体系,要求教师注重“基于大概念来组织单元教学内容,发挥大概念的统摄作用”[1]。单元教学设计需要通过情境、问题、任务、活动之间的逻辑关系,将单元教学组织成一个围绕目标、内容、过程实施与评价的“完整”的探究故事,从而让学生建构结构化知识,习得可迁移的课程核心素养[2]。以现行人教版九年级化学教科书第八单元“金属和金属材料”为例,探索基于大概念的单元教学整体设计与实践,为一线教学提供可借鉴课例。
1 基于大概念的教材单元二次开发
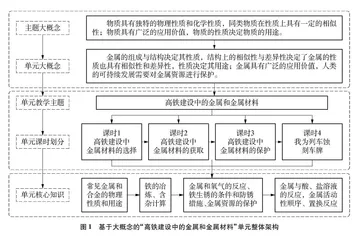
人教版九年级化学下册第八单元“金属和金属材料”由“金属材料”“金属的化学性质”“金属资源的利用和保护”3个课题组成,其知识逻辑为“金属的物理性质与用途→金属的化学性质→金属(铁)的制备、利用和保护”,隐含了“物质具有广泛的应用价值,物质的性质决定用途”等大概念,3个课题之间逻辑递进关系清晰,整个单元相对完整、独立,具有方向上的一致性,因此,适宜作为一个教学单元进行整体性设计[3]。但教材情境素材较为琐碎,缺乏整体连贯性,与学生日常生活经验联系的紧密度还不够。基于2022版课标要求,在“物质的多样性”主题大概念下,凝练出该单元的相关大概念(见图1),选择与学生生活联系较为密切又富有时代感的“高铁建设中的金属和金属材料”作为单元大情境,对教材单元进行二次开发,重构为“课题1 高铁建设中金属材料的选择”[4] “课题2 高铁建设中金属材料的获取”[5]“课题3 高铁建设中金属材料的保护”和“课题4 我为列车蚀刻车牌”4个课题。将核心知识巧妙地镶嵌在由情境衍生的问题解决任务中,学生在完整的探究与实践情境中,建构起对金属和金属材料较为整体的认识,强化学科观念。大概念统领下的单元结构如图1所示。
2 大概念统整下的单元教学目标
根据2022版课标“学习主题2 物质的性质与应用”中“2.1 物质的多样性”“2.2.3 金属与金属矿物”及“2.4 物质性质的广泛应用”等相关内容要求,结合教材内容分析,在图1所示大概念统领下,结合该主题学业要求和单元情境,以“合课标、可观测和可达成[6]”为目标设计原则,设计该单元教学目标及分课时目标,如表1所示。
3 学情分析
学生在学习本单元时的已有知识经验、可能的学习困难及相应的利用策略如表2所示。
4 单元教学流程
以“高铁建设中的金属和金属材料”为大情境,衍生出4个单元大问题:“问题1高铁建设中如何选择金属材料?”“问题2 这些金属材料从何而来?”“问题3 这些金属需要怎样的保护?”“问题4 如何为列车刻蚀一个心仪的Logo?”。学生在这些问题驱动下,在教师的指导、帮助下,通过对学习资源的主动寻求和利用,在自主探索和互动合作的过程中,不断提出问题、解决问题,从而完成任务并实现知识与意义的建构。单元教学流程见图2。
5 单元教学过程
(课题1和课题2教学过程详见参考文献4和5)
5.1 课题3 主要教学过程
5.1.1 情境引入
[资料1]生锈(标注主要成分是Fe2O3·xH2O)的铁轨、较为光亮的车体、高铁弓网系统裸露的铜导线的图片。
[问题]观察这些图片,你有哪些想法?
[学生主要回答](1)铁易生锈,铝、铜不易生锈;(2)想知道为何铁易生锈而铝、铜不易生锈。
5.1.2 任务1 探究铁轨的锈蚀原因和防锈措施
[资料2]我国沿海地区的铁路,由于酸雨、高温、潮湿、盐雾(主要成分为氯化钠)等影响,钢轨和扣件锈蚀都十分严重。以狮子洋隧道为例,在3年时间内,锈蚀严重的区域,剥落厚度达1mm。
[活动1]铁生锈条件探究。
问题1:铁在什么条件下会生锈?如何设计实验验证?
[学生活动表现]学生根据铁锈的成分很快猜出锈蚀因素。铁生锈的条件是铁与氧气和水同时接触,存在两个变量,需要分别验证,开始,大部分学生设计不出探究方案,教师引导学生想“需要几只试管,每只试管除了铁钉还需要放什么”,学生尝试画实验设计图,以“小组讨论—组间分享评价”的形式,选出最优方案。小组完成实验,持续观察一周。
[教师支持]铁生锈的过程比较缓慢,我们提前1周就让学生按下面的设计方案准备了实验并拍了视频。课上播放视频。
学生观看视频,记录现象,商讨结论,探究过程和结果见图3。
[活动2]醋酸、氯化钠对铁生锈的影响探究。
问题2:从资料2看,可能是哪些物质加速了金属锈蚀?请用稀醋酸代替酸雨,设计实验验证。
[学生活动表现]学生认为潮湿、酸雨、盐雾都加速了铁的锈蚀并很快设计出探究方案。学生按方案完成实验,持续观察一周。
[教师支持]用氧气含量数字传感器演示实验。
学生通过图像中氧气含量变化情况,发现铁制品在水中锈蚀相对缓慢,在食盐水中锈蚀较快,在稀醋酸中锈蚀最快,对盐类物质和酸能加速铁的锈蚀有了更直观、明确的认知。见图4。
[活动3]自行车等铁制品防锈措施和原理探究。
问题3:自行车用了哪些防锈措施?你还知道哪些防锈措施?原理分别是什么?
[教师支持]展示学生不熟悉的搪瓷、烤蓝、镀其他金属的铁制品。
[学生活动表现]学生发表看法,互相补充。活动结果见图5。
[教师追问]高铁轨道用了哪种防锈措施?你认为选用防锈措施需考虑哪些因素?
[学生主要想法](1)高铁轨道长期裸露在野外,且要承受剧烈的摩擦,所以选用合金;(2)除考虑防锈效果,还要考虑实用、美观、成本、有效防锈期等因素。
5.1.3 任务2 探究车体光亮的原因
[活动4]铝粉的燃烧和铝的自我保护实验。
提示:酒精灯灯温能达到670℃,铝的熔点是660℃,氧化铝的熔点是2054℃。
问题4:铝和氧气能发生反应吗?实验现象说明了什么?说说铝合金车体始终光亮如新的原因。
[教师支持]演示“铝粉的燃烧和铝的自我保护实验”。
[学生活动表现]实验前,大部分学生认为铝和氧气不反应。加热后,观察到“铝片红热变软,好像包裹了什么物质,抖动铝片却不滴落,用钢针把红热的铝箔刺破,其中熔融状态的铝不滴落”实验现象时,学生开始不能正确解释,经教师引导、讨论后,了解到铝在常温下表面易生成致密的氧化铝膜,化学方程式为4Al+3O22Al2O3。并能从有致密的氧化铝膜和涂层解释经常清洗和养护角度保持车体光亮的原因。
5.1.4 任务3 探究铜导线的锈蚀和防护
[资料3]据建材网报道:经过重污染地区的胶济线、京沪线,部分路段列车弓网系统的接触线表面生成铜绿[Cu2(OH)2CO3],强度降低,甚至开断脱落,引起弓网故障。
[活动5]在空气中加热铜丝。
问题5:铜锈蚀的条件是什么?写出铜和氧气反应的化学方程式,高铁上如何防止铜锈蚀?
[学生活动表现]学生很快说出铜在氧气、水、二氧化碳共同作用下生成铜绿。实验前,大部分学生认为铜和氧气能反应,依据是铁、铝都能和氧气反应;少部分学生认为铜和氧气不反应,依据是常见的铜制品一般都很光亮。观察到加热铜丝表面变黑,并且擦拭不掉后,能正确写出化学方程式2Cu + O2 △2CuO。综合多种因素认为在高铁建设中应选用铜合金减少锈蚀。
[教师追问]铁、铝、铜和氧气反应的难易和剧烈程度说明了什么?是否所有金属和氧气都能发生反应?
[学生活动表现]学生已经意识到反应的难易和剧烈程度体现着金属的活泼性,通过讨论、归纳,能判定铝比较活泼,铁、铜次之,金最不活泼。
5.1.5 任务4 探究我国金属资源的现状和保护
[资料4]2021年,我国科学家们用竹子做原料,研发出的竹缠绕复合材料已正式投入到高铁车厢的建造中。
[活动6]我国金属资源现状调查汇报。
问题6:竹缠绕复合材料用于高铁车厢的意义有哪些?我国金属资源现状如何?采取了哪些保护措施?
[学生活动表现]能从节约金属资源和“提速”角度分析新材料的使用意义。结合课前调查,小组互相补充,能给出关于金属资源现状和保护的完整答案。
5.1.6 任务5 我为列车设计Logo
[活动7] 课后请你为自己心目中的高铁列车设计1个喜欢的Logo。
5.2 课题4 主要教学过程
5.2.1 任务引入
[教师]前面我们已经为高铁建设选择了材料,今天我们的任务是将你们设计的列车logo刻在金属表面上。
[播放视频]“什么是金属蚀刻”。
“金属蚀刻”需要先将蚀刻的图形转移到金属基材上,基材与蚀刻液接触后,保护膜以外的部分会溶解腐蚀,形成凹坑,蚀刻的图形就出来了。
5.2.2 任务1 清除基材表面杂质
[资料]工业处理大量金属基材时常用“酸洗”,“酸洗”是利用酸溶液去除金属表面上的氧化膜和锈蚀物的一种清洁金属表面的方法。比如用盐酸去除铁锈,盐酸会和氧化铁反应生成氯化铁和水。“酸洗”时间不宜过长,在酸溶液中加入“缓蚀剂”能最大程度降低酸雾、防止析氢。
[活动1]酸洗处理氧化膜原理探究。
问题1:金属表面可能有哪些物质?写出盐酸(或稀硫酸)和氧化铁(或氧化铝)反应的化学方程式, “酸洗”时间过长会怎样?还可以用什么方法将表面处理干净?
[学生活动表现]学生知道金属表面有油污、氧化膜等杂质和用砂纸打磨能清除杂质。能按资料提示正确书写酸和金属氧化物反应的化学方程式。能猜出“酸洗”时间过长金属基材会和酸反应。
[活动2]铁、铝、铜和盐酸(稀硫酸)的反应探究。
问题2:哪些金属能和酸发生反应?反应的剧烈程度如何?生成了哪种气体?从反应物和生成物的物质类别看有什么特点?属于哪种反应类型?
[学生活动表现]小组设计并完成实验,用点燃法检验氢气,记录现象,能仿照锌和稀硫酸反应制取氢气正确书写化学方程式。意识到可以根据金属和酸是否反应判断金属的活泼性。在教师提示下,能从物质分类角度定义置换反应。
5.2.3 任务2 选择蚀刻液
[师]金属蚀刻是反应掉金属表面不需要的部分,从上面实验我们知道,可以用酸蚀刻铝和铁,但铜与酸不反应。我们还学过哪种物质能和金属发生反应?
[学生]铁和硫酸铜溶液能反应。
[活动3]金属与金属化合物溶液反应探究。
问题3:实验现象与你的预期是否相符?铝、铜、银的金属活动性顺序是怎样的?常见金属在溶液中的活动性顺序是什么?
[学生活动表现]按教材第11页“探究”完成实验,实验现象激发了学生浓厚的兴趣,并能用金属活泼性解释现象。在教师引导下认识“金属活动性顺序表”。