基于学术性情境的大概念教学
作者: 刘瑞 王惠霖 袁绪富 郑长龙
摘要: 在新时代背景下,创新是化学学科核心素养的特质。开展基于学术性情境的大概念教学,是促进拔尖创新人才培养的重要方式。以选择性必修“原子结构”主题为例,在“激光与晶体”学术性情境中,以跨学科大概念“能量”和学科大概念“结构决定性质”为统领,围绕激光光源的发光原理和晶体的光学性质两个板块设计系列问题。学生在解决问题的过程中理解和掌握“原子结构”主题的基本概念,形成化学思维,发展化学学科核心素养。
关键词: 原子结构; 学术性情境; 大概念
文章编号: 10056629(2023)08003307 中图分类号: G633.8 文献标识码: B
在新时代背景下,创新是化学学科核心素养的特质[1]。《普通高中化学课程标准(2017年版)》(以下简称“高中新课标”)指出:“真实、具体的问题情境是学生化学学科核心素养形成和发展的重要平台,为学生化学学科核心素养提供了真实的表现机会。[2]”本文为“真实问题情境”赋予了新内涵:“学术性情境”在继承真实问题情境的素养功能的同时,适应拔尖创新人才培养的目的。创新意味着“举一反三”“举一反十”[3],这里的“一”与大概念具有内在的一致性,通过具有概括性和统摄性的大概念实现“一到多”的目的。因此,大概念教学是培养学生的创新能力的重要途径。
“原子结构”是高中化学的核心内容,是解释和预测元素性质的重要理论,对学生认识化学微观世界的特殊性具有重要意义。同时,微观世界抽象性较强,其认识思路与学生已有的宏观思维方式具有显著差异,是化学教学的难点。目前,较少有研究在新时代拔尖创新人才培养的背景下,探索“原子结构”主题的教学设计[4]。本研究以高中化学选择性必修“物质结构与性质”模块“原子结构”主题为例,探讨基于学术性情境的大概念教学,为指向创新的高中化学教学实践提供参考。
1 学术性情境
教学需要创设适当的情境,以促进学生的自主建构,情境是一切认知活动的基础[5]。真实问题情境能够促进学生积极主动地建构理解,整合和发展知识结构,同时有助于培养学生解决实际问题的能力。
创新是化学学科核心素养的特质[6]。因此,有必要探索指向创新的真实问题情境的新内涵。高中新课标将高中化学课程划分为必修、选择性必修和选修三类[7]。其中,必修阶段面向所有学生,旨在发展全体学生化学学科核心素养,因此课标中必修阶段的教学情境素材多与日常生活及社会相关[8],整体而言具有基础性;而选择性必修阶段面向的是未来将要从事化学相关职业的学生,承载着探索化学、深入认识化学的功能。因此,为更好地适应拔尖创新人才培养的需求,选择性必修阶段的教学应注重学术性情境的创设,学术性情境拓展了真实问题情境的内涵。所谓学术性情境,指的是与纯化学研究或应用化学研究相关的情境,这类情境往往取材于学术前沿,能够引发真实的学术问题。其中既涵盖了相关化学知识、方法,又能体现化学研究的思维和化学的本质,是创新的重要载体。将学术性情境融入常规教学内容,赋予了内容创新的属性,内容不再是表面化、散点的静态知识,而是被学术性情境“激活”的“活知识”,从而实现知识的素养化和功能化。只有具备活知识的人,才能具备解决真实问题的素养和创新的能力。学术性情境既继承了真实问题情境的素养功能与价值,又是站在拔尖创新人才的需求下对真实问题情境的丰富与发展。
2 大概念及大概念教学
《义务教育化学课程标准(2022年版)》(以下简称“义务教育新课标”)将“构建大概念统领的化学课程内容体系”确立为课程理念之一[9],这意味着对大概念的理解及运用大概念开展教学是亟待研究的重要议题。
当前,大概念作为课程的核心和锚点,除了在理论层面从多个维度解析其内涵,其在教育教学实践中的应用,即探讨大概念教学的实施,具有更为重要的现实意义。大概念教学追求认知的结构化,使之成为一种反映专家思维的活知识,在新的情境中可以被激活和运用[10],这就与关注专家结论的传统式教学区别开来。创新是专家思维的核心特征[11],学生运用专家思维解决问题,符合素养导向的课程的总体要求。大概念教学指向培养解决真实性问题的素养,这与学术性情境的素养功能具有内在一致性,因此,大概念教学应注重直接指向学科本原性问题解决的学术性情境的创设[12]。根据大概念的属性,可以推导出围绕大概念教学需要:(1)基于化学学科本质深入理解所教主题的内容体系,提炼出具有统摄性的大概念,结构化地呈现教学内容;(2)基于学生的发展需求准确把握大概念的素养功能,发挥大概念在课程知识与核心素养之间的桥梁作用;(3)重视设计迁移性问题,大概念的生成经历“具体→抽象→具体”的循环过程,不仅从真实情境中来,还要回到真实中去。通过将大概念迁移应用于新的情境,促进学生对大概念的深度理解,并在此过程中提升创新能力。
3 “原子结构”教学设计与实施
3.1 教学设计基本理念与思路
大概念与其说是概念,不如说是一种观念,一种思维方式,是经历一定学习历程后所形成的对自然与社会更加抽象的一般看法[13],即大概念是一种认识视角或透镜。教师无法把所有知识教给学生,但可以帮助学生建立看待世界的透镜,尤其是在知识激增的信息化时代,将大概念作为认识视角的设计理念显得更具价值。
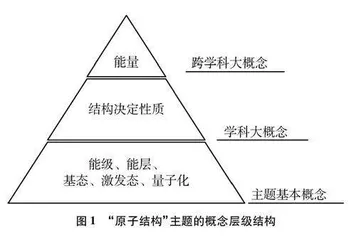
“能量”和“结构与功能”是跨学科大概念[14, 15],其中“结构与功能”包含了“结构”和“功能”两个要素,“结构”这一要素在化学中常具体表述为“结构决定性质”,是“宏观辨识与微观探析”等化学学科核心素养的具体体现[16]。本节内容基于原子的核外电子排布预测和解释元素性质,承载着深化理解“结构决定性质”大概念的功能与价值。本研究采用自上而下的方式,显性化地将跨学科大概念“能量”及学科大概念“结构决定性质”作为组织原子结构主题内容的线索,为学生提供认识主题基本概念的视角,引导学生基于大概念解决学术性情境中产生的问题,从而学习原子结构主题下的基态、激发态、能层、能级等基本概念(如图1所示)。同时,原子结构主题的基本概念成为深入理解跨学科大概念和学科大概念的重要支撑。主题基本概念与大概念之间相互作用,相互促进。所以厘清概念之间的关系,识别主题的基本概念、跨学科大概念与学科大概念,对加强大概念的统摄性,促进以大概念为统领的结构化教学设计具有重要的方法论意义。
本课例的“激光与晶体”学术性情境是在与“非线性光学晶体”科研人员(致谢中提及)讨论过程中产生的。这一领域属于学术前沿,且具有重要的应用价值,我国学者在这一领域处于世界领先水平。基于“激光与晶体”学术性情境,围绕激光光源的发光原理和晶体的光学性质两个板块设计系列问题,学生在解决问题的过程中建构“能量”和“结构决定性质”的大概念,发展宏观辨识与微观探析、证据推理与模型认知的核心素养,教学设计框架如图2所示。
3.2 教学目标
(1) 基于学术性情境“激光与晶体”,在解决问题的过程中理解跨学科大概念“能量”和学科大概念“结构决定性质”,形成认识原子结构的基本视角。
(2) 通过探讨激光光源的发光原理及光谱学事实对原子结构模型的挑战,理解基态、激发态、量子化、能层、能级等主题基本概念;体会模型对认识微观世界的重要作用,理解化学模型建构和修正是基于证据的推理;发展证据推理与模型认知的核心素养。
(3) 通过探讨不同晶体光学性质差异的原因,掌握原子核外电子排布的构造原理,能够书写核外电子排布式;深化对“结构决定性质”学科大概念的理解并迁移;发展宏观辨识与微观探析的核心素养。
3.3 教学实施受篇幅所限,教学实施过程做了简化处理,师生互动中的语言做了适当修饰。
3.3.1 创设学术性情境
[学术性情境]激光是20世纪以来继核能、信息技术、生物技术等之后人类的又一重大发明,被称为“最快的刀”“最准的尺”“最亮的光”。
我国在激光领域的研究处于世界前沿,是世界上少数能够制造实用深紫外全固态激光器的国家。深紫外光属于不可见光,波长比200nm还小,能量高,非常难取得。
这就需要依靠一类特殊的晶体,当激光光源打入这类晶体后,波长会显著减小。
其中,能输出深紫外光的典型晶体是氟代硼铍酸钾(KBe2BO3F2,简称KBBF),我国的陈创天院士团队首次将该晶体生长到能够应用的程度[17],这一技术领先了美国15年[18]。
科学家们对于深紫外区域晶体的探索从未止步,如氟代硼锌酸铯(CsZn2BO3F2,简称CZBF)[19],二者的性质对比如下表所示。
[核心问题]激光光源的发光原理是什么?为什么KBBF与CZBF的光学性质存在差异?这些问题的答案都离不开对原子结构的认识,今天我们就一起来从能量的视角学习原子结构的相关知识从而解决这些问题。
3.3.2 板块1:解决激光光源的发光原理
[核心问题1]激光光源的发光原理是什么?
[教师讲解]光的产生离不开原子中电子的能量变化,当电子从高能态跃迁到低能态时,会以光子的形式释放能量。相应地,电子从低能态跃迁到高能态时,会吸收能量。我们把处于最低能量状态的原子称为“基态原子”,处于较高能量状态的原子称为“激发态原子”。
不同元素原子中的电子发生跃迁时会吸收或释放不同的光,这些光可以用光谱仪来摄取,从而获得原子光谱。
[讨论]根据卢瑟福(E. Rutherford)的原子结构模型,电子绕核做高速运动。在这个过程中,辐射出的电磁波频率应该是连续的,因此理论上应得到连续光谱。然而,实验事实表明氢原子发射光谱是线状的,这该如何解释呢?请大家小组讨论。
[学生]氢原子内部的能量是不连续的。
[教师总结]线性光谱说明能量是不连续的,我们把这种不连续性称之为“量子化”,这正是玻尔原子结构模型的进步之处。
[教师讲解]在玻尔(N. Bohr)原子结构模型中,核外电子按照能量的不同进行分层排布,称之为“能层”,用符号n来表示,每一层分别用K, L, M等来表示。
[讨论]实验事实对玻尔原子模型也提出了挑战:用高分辨率光谱仪观察氢原子中的核外电子由n=2的状态跃迁到n=1的状态,得到的是两条靠得很近的谱线;与此类似,Na原子的核外电子在n=3的层内跃迁形成两条双黄线。这该怎么去解释?
[学生]说明即使是同一能层的电子,能量可能不一样。
[教师讲解]说明同一能层的电子,还存在不同的能量状态,称之为“能级”。
[讨论]能级符号与所能容纳的最多电子数如下表所示。从这张表中,你们发现了哪些规律呢?大家小组交流讨论一下吧。
[学生]每个能层中的能级数等于其能层序数;每一能层最多可容纳的电子数为2n2;s, p, d, f能级最多可容纳的电子数分别是2, 6, 10, 14。
[教师总结]通过刚才的一系列活动,我们总结了许多规律。原子结构属于微观层面,无法直接观察到,因此需要借助模型来使其可视化。而模型的构建与优化离不开实验的证据以及基于证据的推理。同学们以后在从事与化学相关的活动时,也要重视模型的思想以及基于证据进行推理。
3.3.3 板块2:探讨晶体光学性质的差异
[核心问题2]在解决了光源的问题之后,我们来探讨晶体的问题。为什么KBBF与CZBF的光学性质存在差异?
[学生]可能是二者的结构不同。
[教师引导]同学们提到了结构,很好,结构决定性质!
这两种晶体都是层状结构,其中K与Cs起到的是连接层与层之间的作用,并不会对物质的光学性质产生决定性的影响,那它们最大的差别在哪呢?
[学生]一个是Be,一个是Zn。
[教师讲解]那Be与Zn又有什么不同呢?这就需要了解Be和Zn的核外电子排布情况。根据能量最低原理,核外电子应该首先排布到能量较低的能级中,以使整个原子处于能量最低的状态,这样的原子才更稳定。
核外电子排入能级中的顺序遵循“构造原理”,也就是能量最低原理。这是科学家们基于光谱学事实,得出的一个经验规律。如下图所示,小圆圈表示一个能级,每一行对应一个能层,箭头引导的曲线显示新增电子填入能级的顺序。