基于HPS教学模式的单元教学实践
作者: 孙幸 黄劲嵩 李惠云 李玲
摘要:以“氯及其化合物”为例,将HPS教学模式应用于高中化学单元教学实践。在单元教学目标的引领下,通过厘清史实脉络,分析教学中的哲学思想。以“氯及其化合物的发现史和应用史”为明线设计教学情境,以“氯及其化合物的性质”为暗线融汇学科知识实施教学,旨在培养学生的哲学思维和提升化学学科核心素养。基于课前制定的《课堂活动表现评价表》对整个单元学生课堂学习表现进行评价,落实“教学评”一体化观念。
关键词:HPS教学模式;核心素养;单元教学;氯及其化合物
文章编号:10056629(2023)12004807
中图分类号:G633.8
文献标识码:B
《普通高中化学课程标准(2017年版2020年修订)》提出,结合人类探索物质及其变化的历史与化学科学发展的趋势,引导学生形成化学学科观念、培养社会责任感,并强调实施发展学生核心素养的单元教学,让学生在形成完整的知识体系的基础上发展化学学科核心素养和思维能力[1]。化学作为一门自然科学,渗透着守恒、平衡、辩证唯物主义等哲学思想。在化学教学中培养学生的哲学思想,有利于学生更好地理解化学知识,形成科学的世界观。以往“氯及其化合物”的教学多以单课时为主,进行单元整体教学的实践较少,尚未在教学中渗透通过现象看本质、实践认识实践和辩证地看待问题等哲学思想[2,3]。为此,本文以“氯及其化合物”为例,实施基于HPS教学模式的单元教学,拟为高中化学元素化合物教学提供参考。
1 设计理念
HPS(History,Philosophy and Sociology of Science)教育是融入科学史、科学哲学和科学社会学的教育,教学模式有孟克和奥斯本“融合模式”、马修斯对话模式等[4]。HPS教育以史为鉴,体现科学技术与社会发展的联系,引导学生运用哲学观点看待事物的发展,培养学生的思辨能力和社会责任感。单元教学是连结宏观课程与微观课时的桥梁,要求教师钻研课标、分析教材和学情、整合重组教学内容、规划设计课时教学[5]。
将HPS教学模式应用于单元教学实践,以化学史为“明线”设计单元情境,以化学知识为“暗线”融汇其中,引导学生关注化学理论推演的论证过程,根据史实提出假设,设计实验与检验等,感悟科学知识发展过程中的争论和更替;以哲学视角审视科学知识的动态生成过程,阐述科学的性质与意义,辩证看待科学知识、科学方法的发展,为学生认识世界提供有效手段;以科学社会学的角度追问科学知识的传播,感悟知识的产生与社会背景之间的关联,明白科学的时代性和发展性,提高学生运用所学知识参与社会性议题讨论的意识。
2 内容分析
2.1 教学内容分析
本单元选自人教版(2019年)高中化学必修第一册第二章第二节,课标情境活动建议结合真实情境或通过实验探究了解氯及其化合物的主要性质[6]。2019年版教材增加了氯气的工业应用、氯气的毒性等内容,加强化学与社会生产的联系,引导学生形成正确的价值观。氯气可类比活泼金属钠的学习,综合应用物质的分类及转化、氧化还原反应等内容,建构“结构性质用途”的认识思路,为后续铁及其化合物的学习建立物质性质及转化的思维框架。
2.2 科学史实梳理
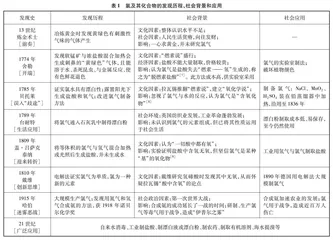
本案例通过分析社会背景,厘清史实脉络,以“氯及其化合物的发现史和应用史”(见表1)为明线设计教学情境,以“氯及其化合物的性质”为暗线融汇学科知识,从社会学的角度感悟学科实践意义,升华学科价值。
2.3 科学哲学分析
本案例通过分析氯及其化合物知识中蕴含的化学基本观念,确定要培育的化学学科核心素养,并通过对科学知识发展过程进行哲学省思,提炼本单元培育的哲学观念(见表2)。
3 单元教学设计
3.1 教学目标
(1)通过设计和实施实验方案验证氯气的史料,了解氯及其化合物性质并形成“实践认识实践”的哲学思维。
(2)通过对不同价态含氯物质转换过程的理论分析、实验验证和符号表征,初步建立基于原子结构、元素价态和物质类别对物质性质进行预测和检验的认知模型。
(3)通过探讨含氯物质在生活中的应用等社会性科学议题,建立氯及其化合物性质与生活应用的联系,认识化学学科的社会价值,形成正确的价值观念。
(4)通过分析含氯物质的研究和应用的史料,感悟知识的修正过程与科学发展的艰辛,形成辩证思维和探索未知、崇尚真理的态度。
3.2 教学流程
本单元采用HPS孟克和奥斯本融合模式,将其“六阶段”操作步骤与单元内容相结合,划分为4课时进行教学。教学流程见图1。
3.3 评价方案
依据课标学业要求,结合教学活动细化评价内容,制定单元课堂活动表现评价表(表3),为教师的后续教学和学生的学习活动提供参考[10]。
4 教学实录
上述教学流程所展示的4个课时均已实施,以下教学实录展示本单元核心活动第2课时整课时与第4课时活动44如下。
4.1 活动21:探究氯水的漂白性
[回溯历史]第3组学生分享贝托莱对氯气的研究史(见图2)。
[史料分析]舍勒发现氯气可使有色鲜花退色,认为氯气具有漂白性;贝托莱发现氯水具有漂白性。可将有色纸条分别放入氯气和氯水中,观察纸条的退色情况,检验他们的结论。
[设计并完成实验]如何制取氯气?
[舍勒、贝托莱制取氯气]舍勒用盐酸和软锰矿混合加热制取氯气,可当时盐酸成本昂贵,贝托莱做了改进,但制取装置较为复杂,且氯气有毒,不宜大量制取。
[聚焦社会应用:创新制法]疫情期间大量使用的84消毒液,主要成分是NaClO,洁厕灵主要成分是浓盐酸,两者混用会发生反应:NaClO+2HCl====NaCl+H2O+Cl2↑,此反应可简易制取少量氯气,探究氯气与氯水的漂白性。
[史实检验:学生实验1]
实验物品:84消毒液、浓盐酸、红纸条(干、湿)、深井穴、大烧杯
实验设计:氯水与氯气的漂白性探究设计及现象。
[实验总结]氯气没有漂白性,氯水有漂白作用。
[深入探究:学生实验2]将紫色石蕊溶液迅速滴入氯水中,观察颜色变化。
[实验总结]氯水先变红说明呈酸性,后退色说明具有漂白性。
[教师引导:学生反思]氯气与水的反应为歧化反应,氯元素一部分做氧化剂,化合价升高到+1价,生成HClO;一部分做还原剂,化合价降低。请同学们根据氧化还原理论书写化学方程式。
[学生板书]Cl2+H2O====HCl+HClO。
[教师补充]次氯酸具有弱酸性,酸性小于碳酸,也能使紫色石蕊溶液变红。
[史实感悟]根据以上研究,氯水中漂白性的物质是什么?贝托莱发现的“含氧化物”是什么?在贝托莱研究过程中得到何种启发?
[学生]盐酸不具有漂白性,具有漂白性的物质是次氯酸。贝托莱并未质疑“氧化学说”的正确性,他发现的“含氧化物”是氯气与水反应生成的次氯酸,我们应明白科学知识是发展变化的,要敢于质疑,追求真理。
[活动表现评价]学生能在贝托莱研究史中发现问题,提出假设,根据氯气的实验室制法设计方案验证氯水的漂白性,同时能用氧化还原理论书写氯气与水反应的方程式,实现氯元素不同价态间的物质转化,但实验创新部分仍需教师引导,小组合作完成操作。
4.2 活动22:探究次氯酸的性质
[史料分析]贝托莱将氯水置于阳光下,失去了漂白作用,同时生成盐酸与氧气,说明“含氯化物”不稳定。
[数字化实验]采用数字化实验验证次氯酸光照分解产物结果如图3所示,请同学们观察曲线变化,得出相应结论。
[图像分析]根据图3可得:(1)氯水的pH随时间增加而减小,说明H+浓度增大,酸性增强;(2)溶液中生成了Cl-;(3)生成了O2,即次氯酸光照分解生成HCl
和O2。
[学生板书]2HClO光照2HCl+O2↑。
[教师引导]请从氯元素价态的角度分析HClO的性质。
[学生]HClO中氯元素的价态为+1价,易得电子,具有强氧化性。
[教师]次氯酸的漂白性是由于其具有强氧化性能使有机色素和某些染料退色,且次氯酸的强氧化性能杀死水中病毒,起到杀菌消毒的作用。
[生活应用]贝托莱发现氯水具有漂白性,但是易失效,不利于使用,我们如何将次氯酸的漂白性应用于生活呢?
[史实应用]台耐特对氯气进行研究,制成了漂白粉。
[活动表现评价]多数学生能分析HClO中氯元素的价态得出其具有强氧化性,认识到氯水漂白性的实质;但图像分析作为高中化学难点,仅少数学生能依据图像数据得出HClO的分解产物,并用化学方程式进行表征。
4.3 活动23:推理漂白粉制造、漂白、失效原理
[回溯历史]第4组学生分享台耐特对氯气的研究史(图4)。
[社会应用]随着英国工业革命的发展,纺织业兴旺起来,漂白需求量增大,台耐特发明的漂白粉漂白效率高、成本低,可供寻常百姓使用,现今除漂白粉外还有漂白液(主要成分NaClO)。书写Cl2与NaOH溶液反应的方程式可类比Na与CuSO4溶液反应,先分步后综合。
[学生板书](1)Cl2+H2O====HCl+HClO;
(2)HCl+HClO+2NaOH====NaClO+NaCl+2H2O;
(3)Cl2+2NaOH====NaClO+NaCl+H2O。
[漂白原理分析]从离子反应的角度,如何将NaClO转化为HClO发挥漂白作用?
[师生共同讨论]空气中CO2与水反应生成H2CO3,H2CO3酸性强于HClO,可提供H+与ClO-结合成HClO。
[学生板书]Ca(ClO)2+CO2+H2O====CaCO3↓+2HClO。
[失效分析]次氯酸不稳定,见光易分解,应密封避光保存。
[史实感悟]台耐特虽然并未认识到氯是一种新的元素,但他积极将其化合物的性质运用于社会生活,充分体现了化学对人类生产生活的应用价值。
[活动表现评价]多数学生能根据台耐特的研究体会化学对社会的贡献,简明清晰地表述小组成果,跟随教师的引导得出漂白粉的漂白原理,但仅有少数学生建构先分步再综合的认识模型,正确书写方程式。