指向深度学习的化学定量实验教学
作者: 叶佩佩 喻俊
摘 要 以“酸碱中和滴定”教学为例,从教学实践中的问题出发,梳理定量实验的思维过程,结合具体的实施路径,引导学生逐步建立起解决定量实验问题的一般方法和思维模型,提升对定量实验的设计及处理能力,实现深度学习,发展“科学探究与创新意识”化学学科核心素养。
关键词 深度学习 酸碱中和滴定 定量实验 实验探究 教学策略
作者简介:叶佩佩(1993— ),女,上海人,同济大学第一附属中学一级教师,硕士,研究方向:高中化学课程、教材、教学研究;喻 俊(1992— ),男,上海人,上海交通大学附属中学一级教师,硕士,研究方向:高中化学课程、教材、教学研究。
一、问题背景
化学实验有定性实验和定量实验之分。相比于定性实验,定量实验需要学生具有较高水平的思维能力。在定量实验教学中,教师习惯直接运用科学语言阐释实验原理并给定实验方案,再通过试题训练强化学生对知识点的掌握,弱化定量实验的探究价值。这种通过简单描述、重复记忆和强化训练等方式学习新知识的学习形式,属于浅层次学习。以“酸碱中和滴定”为例,教学中一般直接提出用酸碱中和反应来测量未知浓度的酸或碱溶液的浓度,然后介绍指示剂的选择,学习实验操作,进行误差分析。在具体落实上,从滴定原理、实验操作(实验课)、误差分析等三个环节展开。实践表明,该实验仍有诸多值得进一步讨论的地方,例如,学生理解每一步操作的真正意义吗?如何体现该实验的“探究”特点?强酸滴强碱、强碱滴强酸的指示剂选择有区别吗?该实验是先讲后做、先做后讲还是边讲边做,哪一个效果好?学生能自主设计出滴定仪器吗?该实验的思想方法对其他滴定实验有何启示?这些问题的解决,将有助于学生理解、归纳、掌握、运用、迁移知识,更加积极主动地建构知识,从而实现深度学习。
二、教学分析
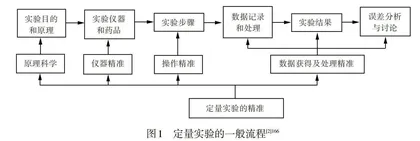
《普通高中化学课程标准(2017年版2020年修订》将“酸碱中和滴定”作为选择性必修的必做实验之一[1]105,因为该实验对培养学生的定量思维能力具有不可替代的作用。对于定量实验,应该从实验原理、装置原理以及操作原理等角度尽可能地提高实验的精准性。定量实验需要关注:(1)依据实验原理设计科学、合理的实验方案;(2)将实验方案具体化,包括设计精准的实验操作步骤、确定定量实验仪器和药品用量等;(3)开展实验,观察实验现象,准确记录并处理实验数据,得出实验结果;(4)对实验进行反思,形成对定量实验的整体认识,逐步建立起处理定量实验问题的一般流程,如图1所示。
“酸碱中和滴定”需要学生运用物质的量、物质的量浓度等知识,了解为什么可用酸碱指示剂的变色来判断滴定终点,理解酸碱中和过程中溶液pH的变化特征,掌握新仪器的使用方法,结合相关知识解决化学变化中的定量问题,以此进一步感受“精准性”在定量测定中的意义和价值。从教学设计角度看,需要从“量”的角度出发设计实验,围绕“定什么量”“如何定量”“如何精准定量”逐渐展开,引导学生建构该实验的定量思维过程,如图2所示,逐步形成“定量实验测定的结果要精准”的观念[3]。
哪些因素会影响实验结果的精准度?如何提高实验结果的精准度?这也是学生在定量实验情境中必须面对的核心问题。学生通过逐步解决与实验结果精准有关的问题,体会化学实验的严谨性、先进仪器的优越性,从而激发探索创新的主动性和积极性,促进定量思维的发展。
三、教学实施过程
(一)创设问题,渗透定量实验方案的精准
在教学中,面对“如何测定盐酸(或氢氧化钠溶液)的物质的量浓度”问题时,学生会有什么想法?学生能设计出来不同于教材的实验方案吗?学生的方案和教材中的方案各有哪些特点?如果能够围绕这些问题组织学生进行讨论,将有助于亲历知识的产生过程,以及知识是如何被应用的,从而促进学生对知识的内化、迁移。为了更好地以探究的方式开展本节课教学,在上课前让学生展开对该问题的思考。在思考期间学生不能翻阅课本,以避免教材内容对学生思维的干扰。
课前任务:要精准地测定某盐酸的物质的量浓度,你打算如何完成?简要描述你的实验方案,并说明理由。通过课前思考,得到的结果,如表1所示。
实验方案的优劣是达成目标的关键,要力求实验过程简单、易行,获得的数据具有说服力。从表1可以看出,学生的思维是非常活跃、开放的,能够应用所学知识进行方案设计。当把这些想法在课堂上进行深入讨论后,学生意识到要使结果精准,需要考虑现有实验条件、实验数据收集的可行性、实验操作的方便程度、实验测定结果的精确度等,同时能够发现自己在实验方案设计上的合理和不足之处。例如,方案①使用pH试纸尽管可以简捷、快速地测量溶液的浓度,但是结果比较粗略,并不精确;方案⑦是教材中的实验,但是学生提出了盐酸的挥发性、中和反应热效应可能会影响实验结果,结合教材实验中所用的稀溶液,说明学生的思考是合理的。可见,课前的问题能够有效地激发学生的发散思维,还能够促进学生对教材提出的实验原理、实验操作等形成客观理性的认识,即理解其中的原因,通过处理实验细节,渗透定量实验中的“精”“准”意识。
(二)生成问题,感悟定量实验仪器的精准
与定性实验侧重物质性状、现象及变化的观察等相比,定量实验更关注实验步骤、实验仪器。从表1中可以发现,这些方案大都提到了需要量取“一定体积”的盐酸,但均未说明体积到底是多少。
[师]在设计的实验方案中,量取多少体积的盐酸比较合适?为什么?
[生]由于物质的量浓度与所取溶液的体积无关,多取一点或少取一点都没有关系。体积太少则数据收集不方便,太多则工作量太大。
[师]为了提高所取溶液体积的精准性,可以使用什么量器?理由是什么?
[生]量筒,这是目前知道的精确度最高的量器。不过量筒容量越大,精确度越低。
[师]盛放待测液的容器,选择什么仪器比较合适?
[生]烧杯或锥形瓶。
[师]如何向未知浓度的盐酸中加入氢氧化钠溶液?
[生]使用量筒逐滴倾倒;使用滴管逐滴滴加。
[师]使用量筒可以量出体积,但反应结束时难以准确把握;使用滴管逐滴滴加既耗时耗力,也不便读数。能否将二者的特点结合以来,设计一个新的仪器?画出满足上述条件的仪器形状,并作简要说明。
学生设计的滴定仪器与教材中的仪器如表2所示。
[生]比较不同形式仪器的特点,交流讨论在使用时的方便程度。
[师]滴定管是能够根据需要连续滴加溶液,并且时时准确地读出液体体积的量器。观察滴定管的结构、特点、标示,体会“滴”“定”的内涵。
[生]滴定管上注明了容量、温度、刻度。相比量筒和滴管,滴定管使用起来更方便,溶液体积测量更精确。
通过讨论测定溶液浓度所需要的体积,有助于学生形成在物质检验等实验中“取样”的量化认识。将样品全部用于实验,不仅耗时耗材,也无法进行重复实验。通过对仪器的讨论,一方面学生能够发现之前提供的仪器的不足之处,从而为认识新仪器奠定基础;另一方面有助于学生理解为什么教材上的实验方案是20mL左右,即是由专用仪器的量程决定的。这种认识是必要的,因为教材借助专用仪器或引入关键的实验操作是定量实验的重要手段和方法。学生设计出的仪器基本具备三个特点:有刻度、易滴加、易控制,但是对于如何标注刻度出现了不同的想法。零刻度在上端还是下端?在教学过程中没有将结论直接告诉给学生,而是鼓励学生从仪器使用的方便程度方面考虑并找到答案。化学仪器的形状是多种多样的,而且形状和用法必然与特殊的需求有关,这为学生今后选择化学实验仪器乃至设计仪器装置提供了思维指向。有了专用仪器,如何确定滴定终点呢?
[师]如何确定盐酸和氢氧化钠溶液“恰好”完全反应?
[生]提出判断滴定终点的方案,如表3所示。
[师]方案②中需要pH计进行连续测定,理论可行性高。考虑到现有实验条件,如果使用酸碱指示剂,应当如何操作呢?
[生]使用酚酞,溶液由无色变为红色;使用甲基橙,溶液由红色变为橙色;使用紫色石蕊,溶液由红色变为紫色。
[师]不同酸碱指示剂的pH变色范围,如表4所示。根据表中信息,酸碱指示剂能够准确地指示滴定“恰好”完全反应的那一点吗?
经过调查发现,部分学生认为酸碱指示剂颜色变化是在酸性(pH < 7)、中性(pH = 7)、碱性(pH > 7)条件下的颜色。这是学生的迷思概念,必须得以矫正。让学生先说出自己的想法,再给出酸碱指示剂的颜色变化的pH值,引发学生的认知冲突,从而突出教学重点和难点。根据表4中的数据,无论酚酞、甲基橙或石蕊,都无法准确地指示滴定终点,这属于系统误差。由于石蕊颜色太深,且变化范围太大,通常不作为指示剂。考虑到滴定实验中无论使用甲基橙或酚酞,产生的误差都在允许范围之内[5],因此本实验中两种指示剂都可以选择。
(三)分析问题,反思定量实验过程的精准
结合教材中的步骤[6]60-61,在完成“0.10 mol/L氢氧化钠溶液滴定未知浓度的盐酸”实验后,学生通过亲自动手,初步体会到酸碱中和滴定实验操作与实验结果的精准性密切相关。通过独立实验,学生获得了有关数据,并计算出了实验结果,这些结果与理论值相比,偏大、偏小的情况都有。在进行误差分析时,学生针对可能引起误差的常见案例提出如下问题:
(1)为什么实验过程中没有看到气泡?它是如何产生的?没有气泡会影响实验结果吗?
(2)滴定管尖嘴悬挂液体是什么意思?为什么会出现这种情况?对实验结果影响大吗?
在教学中往往将可能引起误差的操作“全盘托出”,再逐项分析。然而,没有亲自做这些实验,就可能不知道这些问题的来源,即使是做了这些实验,也不一定都出现上述提到的气泡、悬挂液体等情况。仅靠理论解释而没有亲身体验,学生获得的理解是不深刻的,因此实验的误差分析需要充分地尊重学生的实践和体验。只有当学生知其然,也知其所以然,才能够认识到实验结果的准确性与实验过程中各个细节的相关性。如针对(2)中提到的悬挂一滴液体,它对反应终点的影响很大吗?教学中不妨在此时再展开或巩固滴定过程中有关滴定突变的学习,通过理论计算引导学生感受实验操作中“精准定量”的价值。
(四)延伸问题,提升学生综合思维能力
实验操作不仅仅是停留于动手等表面行为,更需要注重实验操作背后的意义与作用。
在实验教学中,通过讲解操作步骤和注意事项,学生主要以机械记忆方式记住实验操作步骤,基本无法说清这些实验操作步骤的必要性。通过在课堂上提供充分的自我思考和讨论空间,学生针对所做实验提出如下问题:
(1)待测液、标准液能否使用同一支滴定管?其他溶液滴定时都有特制的仪器吗?
(2)能否右手控制旋塞,左手拿锥形瓶?
(3)在滴定时速率可以“先快后慢”吗?
(4)将本实验中的盐酸换成醋酸,其他程序完全一样吗?
(5)滴定前和滴定后都仰视(或俯视)进行读数会产生误差吗?
(6)滴定管检漏后烘干,是否可以不润洗?
(7)只要两种溶液能相互反应,就能采用同样的滴定法测定其中一种溶液的浓度吗?
(8)如果两种呈中性的溶液(如Na2SO4溶液和BaCl2溶液)恰好完全反应后溶液呈中性,在滴定时应该如何选择指示剂?
学生对知识的深度学习,不是为了记住文本知识,只会依照范例解决问题,而是需要理解知识中所蕴含的观点、思想、研究方法和思维方式,形成迁移、灵活应用所学知识的能力,回答或解决新情境下陌生问题的能力[7]。学生提出的问题很有深度,能够将该实验中的某些思路和方法进行类比、迁移。例如,(3)中学生发现滴定耗时较多,于是提出“滴定可以先快后慢”吗?不妨让学生思考“先快后慢”的理由是什么,什么情况下可以“先快后慢”?(6)中滴定管检漏后烘干再取溶液,看似可行,但烘干后再盛放液体仍旧无法避免漏液问题,此时可引导学生认识玻璃仪器上标示温度的必要性。教材中的实验操作是静态的,如果不能将静态的学科知识转化为灵动的学科思维,教学的意义是体现不出来的[8]。只有帮助学生厘清这些问题,保护好学生的好奇心,利用好学生的求知欲,才能更好地发展实验素养。