融合真实问题情境的高三深度复习教学
作者: 黄丽琴 李根薰
摘 要 为了适应新高考,聚焦核心素养,以“氢键的再认知”为例,进行真实问题情境引导下的高三化学深度复习教学。从面膜中精华液的主要成分入手,通过创设情境,设置三个任务:从宏观及微观视角深入分析氢键对精华液各组分水溶性的影响,从结构决定性质视角深入分析氢键对防腐剂和多元醇挥发性的影响,从性质决定用途视角探讨基于精华液黏度优化精华液组分。旨在提升学生的探究能力和创新意识,促进“宏观辨识与微观探析”“科学探究与创新意识”等学科核心素养的培养,实现深度复习。
关键词 高中化学 真实问题情境 深度复习 氢键
一、基于真实问题情境的深度复习
《普通高中化学课程标准(2017年版)》重视开展“素养为本”的教学,倡导真实问题情境的创设,开展以化学实验为主的多种探究活动,重视教学内容的结构化设计[1]。深度复习就是基于真实的情境,融入化学知识,提出挑战性问题,以发展学生反思、整合、评价、应用等高阶思维为目标,引导学习者对知识体系进行主动建构、拓展延伸,加深对化学基本概念、基本原理的理解,并有效迁移到真实情境中解决实际问题,在问题解决的过程中进一步深入理解化学知识[2-3]。真实问题情境取材于生产生活,真实的问题也是复杂的问题,学生要解决真实问题,需要通过大量分析综合、类比推理才能找到解决问题的思路。为此,我们尝试以面膜精华液组分与性质关系问题为情境,引导学生深入分析氢键对精华液物理性质的影响,在知识运用中实现知识的深度复习。
二、基于真实问题情境实现深度复习的教学案例设计
(一)基于真实问题情境制定复习目标
1.以面膜中的精华液为研究对象,分析精华液中各组成成分氢键形成情况对溶解度、挥发性、黏度的影响。通过组成、结构与性能的关系分析,复习氢键的形成条件、氢键的数目、类型、强度等知识。
2.通过真实问题的解决,实现对氢键相关知识的深度再认识;掌握利用物质形成氢键进行面膜精华液组分优化的方法。
3.通过大量实际案例分析拓展有关氢键的知识,培养知识的迁移与应用能力,提升学生的逻辑推理能力。
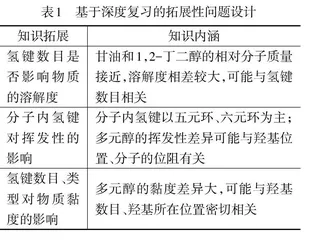
(二)基于深度复习设计拓展性问题(见表1)
(三)促进深度复习的教学过程设计
教学过程以面膜精华液组分与性质关系问题为情境,设置了三个任务,分别从宏观与微观相结合、结构决定性质、性质决定用途三个视角展开分析氢键对某些成分的水溶性、挥发性和黏度的影响。每个任务涵盖两个有梯度的问题,每个问题包含三个逐步深化的学生活动,实现基于真实问题情境有效促进学生深度复习的目的。
【设置任务一】从宏观及微观视角深入分析氢键对精华液各组分水溶性的广泛影响。
【问题情境一】面膜是市面上流行的一种美容保养品,使用最为广泛的是面贴膜,包括膜布和精华液。不同品牌精华液的成分不尽相同,文献表明某精华液的成分比例如下:保湿剂19%~23%,增稠剂0.3%~0.6%,防腐剂0.28%~0.25%,助溶剂0.1%~0.15%,pH调节剂0.18%~0.23%,皮肤调理剂0.2%~0.5%,香精等其他成分0.94%~1.31%,纯水余量[4]。
【设置问题1】精华液中大多数物质水溶性较好的主要原因?但是也有部分物质难溶,如何解决这类物质的水溶性问题?
[学生活动1]从宏观视角分析氢键对精华液溶解度的影响。
[提供资料1]精华液主要成分及溶解度(见表2)。
我们选择了精华液中几种代表性成分,有的是易溶的小分子物质,某些高分子物质也能溶于水,个别高分子物质则不溶于水,由此引发学生讨论。学生观察表2,积极调动关于物质溶解的相关知识,从精华液各组成物质的结构出发分析其溶解性,认为精华液中大多成分含有羟基等极性基团,能与水形成氢键,提高了水溶性。
[学生活动2]从结构角度分析聚二甲基硅氧烷不溶于水的原因。
[提供资料2]文献表明,聚二甲基硅氧烷可以加工成亲醇疏水膜[5](见表3)。
引导学生从微观视角对比黄原胶和聚二甲基硅氧烷的结构。学生联想相似相溶原理,仔细观察后发现,聚二甲基硅氧烷含有较大的疏水基团,可能导致其难溶;再结合氢键的相关知识推测,黄原胶虽然也是聚合物,但是有较多羟基,可以和水形成氢键,所以易溶于水。
[学生活动3]难溶物可以采用助溶剂提高溶解度。请分析助溶剂如何发挥作用?
[提供资料3]对羟基苯甲酸甲酯在不同溶剂中的溶解度(室温下100 g水):甲醇,59 g;乙醇,52 g;丙二醇,22 g;丙酮,64 g。
提示学生精华液成分复杂,如保湿剂不仅可以起到保湿效果,在整个体系中还可以作为助溶剂起作用,引导学生从混合溶剂视角分析添加乙醇、丙二醇做助溶剂的主要作用,即乙醇、丙二醇等能溶解对羟基苯甲酸甲酯等物质,同时乙醇易溶于水,因此,混合溶剂能够增强黄原胶、聚二甲基硅氧烷溶解性。
【设置问题2】如何从微观视角深度分析氢键对物质溶解度影响的微观机制?
[学生活动1]绘制一个精氨酸分子(见图1)与水微观作用示意图,在学案上表示出精氨酸与水分子之间所有可能的氢键:O—H…O、O—H…N、N—H…O。
教师引导学生关注氢键的多样性,并具体分析精氨酸与多个水分子形成多种氢键作用。
展开拓展讨论,从宏观上分析羟基是亲水基,甘油和1,2-丁二醇含较多羟基(见表4),因此,都可以与水以任意比互溶。学生尝试绘制甘油及1,2-丁二醇与水形成氢键微观示意图。
教师引导学生类比冰中水分子间的氢键作用,从成环、成链、成网的角度绘制可能的氢键。
[学生活动2]分析甘油以及1,2-丁二醇水溶性有一定差异的原因(见表4)。
教师引导学生进一步分析甘油以及1,2-丁二醇中结构的差异对水溶性的影响:二者相对分子质量接近,说明范德华力接近;而且形成氢键的都是氧元素,氢键作用能接近,但是甘油中羟基数目多,可形成氢键数目更多,所以溶解度较大一些。
[提供资料1]脂肪二醇中的羟基氢原子与氯化胆碱(ChCl)中的氯原子之间存在氢键作用,并且随着醇中两个羟基之间碳原子数的增多,醇与ChCl之间形成的氢键作用减弱,导致其表面张力增大,极性减小[6]。
引导学生结合资料1和有机化学相关知识,推测甘油与1,2-丁二醇结构上有相似之处,1、2号位碳上均有羟基,但是1,2-丁二醇的3、4号位都是碳原子,而甘油的4号位还是羟基。碳电负性比氧小,乙基是一个推电子基团,可能导致1,2-丁二醇羟基O—H键的极性减小,与水分子间的氢键被削弱,所以溶解性比甘油小一点。
[学生活动3]分析:甘油与水形成的氢键是一成不变的吗?
[提供资料2]水中的氧原子形成氢键的能力比甘油中的氧原子强,而甘油的氢原子形成氢键的能力要比水的氢原子强,因此,当甘油浓度增加时,水形成氢键的能力减弱[7]24。
[提供资料3]有学者研究了微波电场对甘油水溶液体系中氢键的影响,结果表明,在没有外加电场时,水分子在甘油中以团簇的形式存在;随着外加电场强度的增加,甘油与水分子之间的团簇被打开,水分子的排列变得更加有序,甘油与水分子之间的接触面积增加,因此,二者之间的氢键数目增加[7]26。
引导学生在分析问题时要养成变化观念,在微观视角下,物质之间形成的氢键是动态变化的,如甘油的浓度或外加电场都会对甘油与水之间的氢键数目造成一定影响。
[总结]通过微观分析发现,物质的溶解性可能与氢键的数目、强度、结合方式以及物质本身结构等密切相关。
【设置任务二】从结构决定性质视角深入分析氢键对防腐剂和多元醇挥发性的影响。
【问题情境二】为使面膜精华液中各组分尽可能发挥作用,应避免其挥发损失。查阅资料发现,在相同的温度下,物质的蒸汽压越高,挥发性越强。EPA定义易挥发有机物是指在室温条件下饱和蒸汽压大于0.1 mmHg的有机物。乙醇是人们熟知的易挥发物质,它的蒸汽压为59.3 mmHg(25 °C)。
【设置问题1】精华液中对羟基苯乙酮或丁二醇及其同分异构体挥发性为什么存在差异?
[学生活动1]对羟基苯乙酮是面膜中常用的防腐剂,对比表5中对羟基苯乙酮与邻羟基苯乙酮的结构特点,分析这两种物质挥发性大小与什么因素有关?
教师引导学生从微观结构角度分析分子间作用力差异对物质挥发性的影响,类比硫酸和硝酸,前者主要是分子间氢键,沸点较高,难挥发;后者易形成分子内氢键,沸点较低,易挥发。通过分析与类比,学生能将已有知识迁移应用于解决该问题:表5中二者互为同分异构体,由于邻羟基苯乙酮分子内部羟基与羰基接近,能形成稳定的六元环而形成分子内氢键,使得分子的极性降低,削弱了分子间的相互作用,挥发性较高;而对羟基苯乙酮的羟基与羰基相距较远,不能形成分子内氢键,而是形成了分子间氢键,挥发性较低。
[学生活动2]丁二醇是面膜精华液中常用的保湿剂,类比对羟基苯乙酮,如何解释丁二醇的两种异构体挥发性不同?
[提供资料1]文献表明,分子内氢键的化合物一般具有环状结构,多为六元环,五元环较少[8]。
[提供资料2]文献表明,对于位置异构的同分异构体,其分子间作用力大小规律可用空间位阻来判断[9]。
引导学生从结构出发进行深入分析(详见表6):1,4-丁二醇与1,3-丁二醇互为同分异构体。根据资料1推测:1,4-丁二醇如果形成分子内氢键应是一个七元环,不太稳定,因此,1,4-丁二醇主要是分子间氢键;但是1,3-丁二醇形成分子内氢键是一个六元环结构,较前者稳定,因此,在1,3-丁二醇中存在一定比例的分子内氢键,形成分子间氢键的概率减小。根据资料2推测:1,4-丁二醇与1,3-丁二醇形成氢键的都是氧元素,且羟基数目一致,区别在于1,3-丁二醇有支链,位阻较大,形成分子间氢键的概率小于前者,分子间作用力更弱,因此,挥发性更强。
[学生活动3]1,4-丁二醇和1,3-丁二醇哪个物质保湿效果更好?
教师引导学生从保湿剂的作用原理去思考并初步判断:1,4-丁二醇分子间作用力更强,在作为保湿剂时,与水分子间的氢键就会被削弱,保湿效果可能不如1,3-丁二醇。
再组织学生查阅资料发现,相同碳链长度的二元醇含有仲羟基越多,溶液保湿性越好。原因可能是微观上醇水溶液是非均匀溶解的,醇分子会发生自聚。相对于只含伯羟基的醇分子,存在仲羟基的醇分子不容易发生自聚,醇分子通过氢键结合的水分子数目多,保湿性较好[10]。
【设置问题2】丙二醇的两种异构体挥发性高低差异取决于什么?
[学生活动1]1,2-丙二醇与1,3-丙二醇也是面膜精华液中常用的保湿剂,对比表7中二者的挥发性大小,如何解释?
[提供资料1]文献表明,线性邻二醇分子(如1,2-乙二醇,1,2-丙二醇,2,3-丁二醇和1,2-丁二醇)在CCl4中的红外光谱表明,相邻—OH基团间存在分子内氢键[11]。
引导学生从结构决定性质的角度思考并作出推断,1,2-丙二醇和1,3-丙二醇是同分异构体,羟基数目相同,形成氢键的元素都是氧,因此,二者的氢键强弱和数目相差不大。但是挥发性不同,猜测可能是1,2-丙二醇有支链,位阻较大,不易形成分子间氢键。且若形成分子内氢键,是一个五元环状稳定结构。
[学生活动2]依据下述资料2分析需要收集什么证据才能证明1,3-丙二醇分子更容易形成分子间氢键?
[提供资料2]文献表明,1,2-丙二醇与1,3-丙二醇的范德华力基本一致,影响二者分子间作用力的因素主要是氢键。1,3-丙二醇分子内部,羟基氢与羟基氧的最短距离为3.39 Å,而分子间氢键的最短距离为1.82 Å[12]87。
组织学生查阅资料发现,学者采用手持技术数字化实验测定1,2-丙二醇与1,3-丙二醇及其混合物在相同条件下蒸发的温度变化曲线,结果表明,1,3-丙二醇的溶剂化作用要比1,2-丙二醇更弱,温度上升较低[12]89。由此引发学生思考:1,3-丙二醇更容易形成分子间氢键,与水分子形成氢键的概率小于1,2-丙二醇,故温度上升较低。