聚焦思维模型的单元整体复习设计
作者: 朱雅婷 翁菲
“水溶液中的离子反应与平衡”单元是人教版化学选择性必修1第三章《化学反应原理》的内容,是化学平衡理论在水溶液中的应用。本单元旨在引导学生从溶液中存在的粒子、粒子间发生的变化、粒子间建立的平衡等视角,探究水溶液中的离子反应与平衡,树立微粒观、变化观等核心化学观念。复习阶段,笔者以碳酸饮料与人体健康为情境素材,设计一系列问题,引导学生通过初构模型、巩固模型、强化模型、完善模型四个环节的学习,形成解决水溶液中离子反应与平衡问题的一般思路,发展模型构建能力,强化化学思维。
一、引入真实情境,初构模型
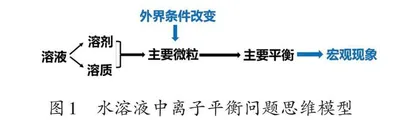
复习伊始,笔者引入情境:“尽管每个人的口味偏好不同,碳酸饮料还是以其独特魅力成为大众公认的‘快乐水’。有趣的是,我们不仅能享用它,还能亲手创造它。”真实的生活化问题情境让学生感受到化学就在身边,从而产生自主探究的兴趣。笔者顺势引导学生用纯净水、柠檬汁和小苏打等制作碳酸饮料,并仔细观察制作过程中这些材料发生反应的现象,进而分析物质反应的本质,从认识物质的宏观性质过渡到探析微观粒子的行为。笔者先让学生思考纯净水中存在哪些微粒。学生回答:水会发生电离,H2O、OH-、H+共存于水中。然后,笔者引导学生把小苏打(碳酸氢钠)加入纯净水中,探讨此时微粒的种类如何变化,以及这些变化带来哪些新的化学平衡。学生通过分析碳酸氢钠在水溶液中的电离,发现微粒种类增加了,即多了Na+和HCO3-,HCO3-的增加使溶液中的主要平衡为碳酸根的水解平衡。最后,笔者引导学生把柠檬汁加入小苏打溶液中,分析这一变化会对原有平衡产生怎样的影响,以及这些影响会引起什么宏观现象。通过操作、观察和讨论,学生发现加入柠檬汁后,溶液中氢离子浓度增大,碳酸氢根离子的水解平衡正向移动,生成碳酸,碳酸因不稳定而分解,产生气泡。通过以上问题的逐步解决,学生提炼出如图1所示的思维模型,这个模型可用于分析水溶液中离子平衡问题。
真实问题的解决过程将零散、孤立的知识重整为系统、整体的知识,帮助学生从微粒观、平衡观的视角形成解决问题的思维模型,进而发展了宏观辨识与微观探析的化学核心素养。
二、创设问题情境,巩固模型
我们往往都经历过这样的情形:饮一大口冰镇的碳酸饮料,不久后会不由自主地打嗝。为了让学生更直观地感受这个有趣的过程,笔者在课堂上先播放一段关于人们喝碳酸饮料后打嗝的视频,并给出如下信息:①碳酸饮料是在一定条件下充入CO2的饮料;②20℃时碳酸饮料溶解CO2的体积倍数不低于2.0倍;③胃液pH为0.9~1.5,碳酸饮料pH为2~5。然后,笔者提问:“为什么喝碳酸饮料容易打嗝呢?”学生尝试利用上述思维模型分析打嗝原因,提出如下设想:碳酸饮料的溶质主要是H2CO3,其中主要存在H2CO3的电离平衡,碳酸饮料进入胃液后,由于胃液中的H+浓度远高于碳酸饮料,这种外界条件的改变促使H2CO3的电离平衡发生逆向移动,原本电离出的H+和HCO3- 重新结合,形成H2CO3,而H2CO3是一种不稳定的酸,容易分解为CO2和H2O,CO2通过食道排出,形成打嗝现象。
学生不仅利用思维模型分析、解决了现实问题,完成了水溶液知识体系的结构化及其认识思路的系统化,还验证了模型的准确性和适用性。
三、呈现复杂情境,强化模型
本环节,笔者引导学生分析、解决更加复杂的混合溶液问题,经历从宏观表征到微观表征再到符号表征的学习过程,强化模型认知。
课堂上,笔者出示如下材料,把学生引入复杂的问题情境中。
26岁的小曹是一名快递员,他每天喝碳酸饮料解渴。“满头大汗的时候来一瓶‘快乐水’,别提多爽了!”小曹说,他每天喝大约2升碳酸饮料。这个习惯让身高170厘米的他,体重飙升至近200斤。半个月前,小曹突然出现口渴乏力、多饮多尿的症状。越口渴他就越想喝碳酸饮料,这导致他的病情加重。小曹无奈之下来到医院就诊,医生确诊他的病因是大量饮用碳酸饮料导致的酸中毒。
学生阅读材料后,笔者提问:我们平时也喝可乐等酸性的碳酸饮料,为什么没有引发酸中毒呢?同时,笔者给出相关信息:血液是一种特殊的溶液,它能帮助人体抵抗外来少量酸性或碱性物质,加上肺和肾脏的调节,血液pH能维持在7.35~7.45范围内,这在医学上被称为血液的酸碱平衡;人体血液中存在H2CO3-NaHCO3等体系,它通过平衡的移动稳定血液pH。为解决上述问题,学生小组合作探究,发现我们平时喝碳酸饮料一般不是连续大量饮用,这相当于给身体外加少量酸,因此血液的pH能够保持稳定。笔者引导学生以血液中的H2CO3-NaHCO3体系为例做具体说明。学生尝试利用思维模型分析血液中的多平衡体系,发现该体系中存在的主要微粒是H2CO3和NaHCO3,存在的主要平衡是碳酸的电离平衡和碳酸氢根离子的水解平衡,当外加少量酸时,血液中H+浓度增加,碳酸根离子的水解平衡正向移动,从而减缓H+浓度的进一步增加,助力人体维持pH稳定,而?当外加少量碱时,血液中OH-浓度增加,碳酸的电离平衡正向移动,从而减缓OH-浓度的进一步增加,助力人体维持pH稳定。
接下来,笔者做演示实验,验证H2CO3-NaHCO3体系维持血液pH稳定的原理。笔者先向60mL人工合成的模拟血液中逐滴加入可乐,用pH计测量模拟血液的pH变化情况,并将数据传入电脑,绘制出图像(如图2)。
经过观察和思考,学生发现:在前1分钟,模拟血液的pH从7.09变为6.97,在后1分钟,模拟血液的pH从6.97变为6.61,可见后1分钟pH的下降幅度更大,这表明随着可乐加入量的增加,模拟血液中的缓冲物质逐渐被消耗,酸碱平衡调节机制逐渐失去作用。笔者点拨:虽然血液能在一定程度上维持pH的稳定,但随着碳酸饮料的过量摄入,这种平衡就会被打破,导致血液pH显著下降,进而引发酸中毒。最后,笔者出示如下问题,引导学生通过计算验证上述结论的正确性。
某缓冲溶液由0.10mol·L-1 的H2CO3和0.10mol·L-1的NaHCO3组成。试计算:①该缓冲溶液的pH;②在1000mL该缓冲溶液中加入10mL1.0mol·L-1的HCl溶液后,该缓冲溶液的pH。提示:碳酸Kal=4.4×10-7,-lgKal=6.36;lg(0.09/0.11)=-0.09。
学生先找到主要平衡即碳酸的第一步电离平衡,接着利用电离平衡常数Kal计算出该缓冲溶液的pH为6.36。然后,学生分析:加入少量盐酸后,HCO3-会与H+反应生成H2CO3,因此加入盐酸后H2CO3物质的量为0.11mol,HCO3-物质的量为0.09mol。最后,学生利用Kal得出加入盐酸后溶液的pH为6.27。
通过传感器定量测定溶液pH变化的实验验证模型的合理性,是实证与理论相结合的表现。在此过程中,学生从定量视角推理,建构了多维视角分析模型。同时,传感器的利用使水溶液中离子平衡的微观本质外显化,让学生更加直观地感受到血液中的酸碱缓冲对能在一定范围内维持血液pH稳定。
四、提供拓展情境,完善模型
本环节,笔者通过引入沉淀溶解平衡,为水溶液中离子问题思维模型增添新的维度,使其更加完善和全面,以便学生在模型指导下灵活运用所学知识解决更加复杂的问题,形成系统思维。课堂上,笔者出示如下新闻。
据媒体报道,在浙江宁波,14岁的晓俊因牙齿疼痛到医院就诊。医生检查后发现,他满口龋齿,好几颗牙已被彻底“蛀空”。医生问诊得知,他每天上学后一口水都不喝,却要连喝三瓶碳酸饮料。
在学生被这则新闻所震惊时,笔者抛出“碳酸饮料真的毁坏牙齿吗?”的问题,并提示:牙齿表面有一层薄薄的起保护作用的釉质;牙釉质的主要成分是难溶的羟基磷灰石[Ca5(PO4)3OH],其饱和溶液中存在沉淀溶解平衡——Ca5(PO4)3OH(s) ? 5Ca2+(aq)+3PO43-(aq)+OH-(aq)。学生结合上述信息小组合作探究得出:碳酸饮料进入口腔后释放H+,这种外界条件的改变使牙齿表面的羟基磷灰石沉淀溶解平衡正向移动,其原本稳定的沉淀状态开始趋向于溶解状态,因此长期饮用碳酸饮料会导致牙齿表面的羟基磷灰石持续溶解,进而形成牙齿酸蚀症。最后,笔者播放视频,展示牙齿放入碳酸饮料中一年期间的变化,让学生更加直观地感受碳酸饮料对牙齿的损害。
为帮助学生强化知识结构,感受化学平衡的调控对生产、生活的重要意义,笔者引导学生回忆学习路径,进一步总结水溶液中离子平衡问题的思维模型,即先分析溶液中的主要微粒,然后找到主要存在的平衡,最后分析外界条件改变所引起的主要微粒数目、种类等的改变,以及这些改变所带来的平衡移动。
此外,笔者提出课后拓展探究问题“试根据本节课所学内容,解释全球变暖加速珊瑚减少的原因”,引导学生体会我国提出“碳达峰”“碳中和”目标所体现的担当精神。
(作者单位:利川市第一中学)