基于双池模型的电解原理教学研究
作者: 黄红红【摘要】以发展学生的证据推理与模型认知学科核心素养为目标,通过分析学生学习电解池内容时存在的困难,结合新旧教材分析,重新建构“原电池-电解池”双池模型提高学生的学习能力。在教学过程中,让学生经历“发现问题→提出猜想→实验验证→得出结论”的证据推理过程,并分别从局部(微观)视角和整体(宏观)视角探究电解池的工作原理。
【关键词】化学教学;双池模型;电解原理;电解CuCl2溶液
【中图分类号】G633.8【文献标志码】A【文章编号】1004—0463(2022)18—0093—05
“证据推理与模型认知”是化学学科五大核心素养之一。其证据推理指从问题情境及已有知识经验中识别、转换或推演,形成主张,并多方收集证据进行论证,从而获得结论,解决问题。表现在化学学习中,即“具有证据意识,能基于证据对物质组成、结构及其变化提出可能的假设;通过分析推理加以证实或证伪;建立观点、结论和证据之间的逻辑关系”。模型认知指“利用模型进行思维的一种方法”,即基于一定的感性认识,以理想化的思维方式对看不见的化学原型客体进行近似、简化的摹写,以揭示其本质和规律的一种科学抽象方法。电化学作为高中化学反应原理模块中重要的组成部分,需要学生深入理解和掌握,但是其知识点较复杂,对学生的认知理解能力及知识运用能力都有较高的要求,导致学生在学习过程中存在诸多困难[1]。如电解池“内电路电子的移动方向、电路电子的移动方向以及电流的移动方向”等知识比较抽象,是看不见摸不着的知识,学生在短时间内接受这类知识有一定的难度,对学生的分析问题能力提出了更高的要求。另外电解池的习题并不是只涉及一个知识点,而是考查学生对电解池知识的系统理解。原电池和电解池装置有诸多相似之处,导致学生经常出现混淆等。
本课时的教学设计以落实学生“证据推理与模型认知”学科核心素养为发展目标,同时着力于解决学生学习电解池内容存在的难点,深入分析新旧版教材,建构双池学习模型。
一、教材研究
本课时教学设计使用的教材是2019年人教版化学必修1化学反应原理。笔者将新教材内容与旧教材内容进行了对比,两版教材中选取的素材均为电解CuCl2溶液,不同之处在于与旧教材相比,新教材中删去了“通电时,电子从电源的负极沿导线流入电解池的阴极,经过阴离子、阳离子的定向移动,再从电解池的阳极流出,并沿导线流回电源的正极”,同时增加了“上述过程可以看作外接电源提供的电能,借助电解池将还原剂(如Cl-)的电子转移给了氧化剂(如Cu2+)”和方法导引栏目。
新教材的方法导引栏目介绍了电化学学习过程的系统思维和方法,其目的在于说明学生学习完本章内容达成的学科思维发展目标,也是教师教学过程中需要落实的教学目标。旧教材“通电时,电子从电源的负极沿导线流入电解池的阴极……并沿导线流回电源的正极”的内容,与新教材“上述过程可以看作外接电源提供的电能,借助电解池将还原剂(如Cl-)的电子转移给了氧化剂(如Cu2+)”的内容,两段内容之间的关系为系统思维中局部与整体的关系。从局部角度分析,学生对电解原理会有更加深入地理解,但是认知难度高。从整体角度分析,学生的认知难度较低,也有助于培养学生的整体思维能力,但是未能深入理解电解原理[2]。基于上述对教材内容的分析,本课时将旧教材从局部深入分析电解原理的内容和新教材从整体分析电解过程的内容进行了整合。
二、建构学习模型
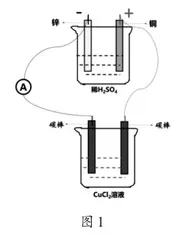
基于教材和教学目标分析重新建构了学习模型。从局部角度分析学生存在的认知难点是难以联想到电子定向移动的路径,为了帮助学生深度理解电子定向移动的路径,结合原电池模型,将教材中电解CuCl2溶液的装置与Cu-Zn原电池装置进行了整合(装置如图1所示)。
图1所示装置中有学生熟悉的原电池模型,从原电池工作原理的角度学生很容易能够理解电子定向移动的路径,且通过推理分析就能够发现CuCl2溶液中发生了氧化还原反应,结合实验验证,便能够建立起对电解池工作原理的系统认识。
三、教学流程
基于对“‘原电池-电解池’双池模型探究电解原理”微主题内容和教学目标的分析,设计了本节课的教学流程,如图2所示。
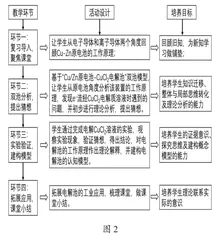
通过以上四个环节,让学生经历基于理论分析发现问题、提出猜想、实验验证、得出结论等一系列思维过程,从而深入理解电解原理,最终自主建构电解池的认知模型,发展局部与整体的学科思维目标,落实本节课的教学任务。
四、教学实录
【环节一】复习导入,聚焦课堂
[教师]同学们在初中已经学习过电解水及利用电解法冶炼活泼性强的金属,但当时我们只是知道电解之后相应的产物,并没有深入讨论电解原理。除此之外,在化学元素发现史上,电解法的出现也作出了极大贡献。1870年,化学家戴维通过电解熔融钾化合物开启了电解法在元素发现史上的新纪元。1800年之前,科学家共发现了20多种元素,而到1850年的时候,就已经发现了50多种,其中大部分元素都是通过电解法获得的。由此我们可以看出,电解作为一种化学实验方法有着非常重要的应用价值,需要深入学习电解原理,为今后的化学学习打好基础。
[设计意图]:设置情境,引出教学主题。
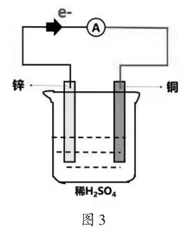
[温故知新]我们刚刚结束了原电池的学习,请同学们根据如图3所示的Cu-Zn原电池装置思考以下问题:从电子定向移动和离子定向移动的角度分析闭合回路。
[学生]外电路:电子从负极(锌片)流出,经过导线流入正极(铜片),构成了外电路;内电路:SO42-向负极(锌片)做定向移动,H+向正极(铜片)做定向移动,构成了内电路。
[教师]结合我们原电池的学习及刚刚分析Cu-Zn原电池闭合回路的过程,请同学们思考电子导体和离子导体定向移动的路径有什么特点?
[学生]电子导体只能沿着金属或导线做定向移动,而离子导体只能在电解质溶液中做定向移动。
[教师]我们可以形象地总结为“电子不下水,离子不上岸”。
[设计意图]:唤起旧知,为新知学习作铺垫。学生通过回忆原电池的工作原理,强化电子导体和离子导体定向移动的特点及闭合回路分析的过程,为后面电解池中闭合回路的分析作铺垫。
【环节二】双池分析,提出猜想
[交流研讨]如图4所示是检验氯化铜溶液导电性的实验装置图,请同学们根据所学电解质的相关知识思考以下两个问题:①电流表的指针是否会发生偏转?②CuCl2溶液导电的原因是什么?
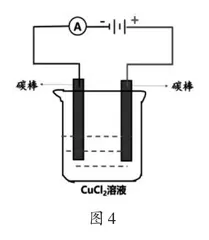
[学生]①电流表的指针发生了偏转;②CuCl2溶液导电的原因是溶液中有自由移动的阴阳离子,且做定向移动。
[问题1]那么Cu? Cl2溶液中的阴阳离子如何做定向移动呢?现在老师将图4中的电池换成我们熟悉的Cu-Zn原电池,同学们根据图5所示的装置图分析CuCl2溶液中的阴阳离子如何做定向移动?(提示:从原电池电流流向角度进行分析)
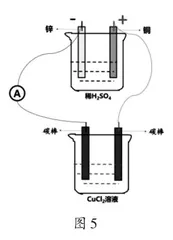
[学生]原电池外电路的电流流向为:正极→负极。如上所展示的装置图中可以将导线及Cu? Cl2溶液看作是原电池的外电路,那么CuCl2溶液中的电流流向符合原电池外电路的电流流向,即从右到左。
[问题2]我们知道产生电流的原因是带电体做定向移动,且电流的方向与负电荷定向移动的方向相反,与正电荷定向移动的方向相同,基于此同学们分析CuCl2溶液中阴阳离子如何做定向移动?
[学生]电流的方向为从右到左,那么Cu2+向与电源负极相连的碳棒做定向移动,Cl-向与电源正极相连的碳棒做定向移动。
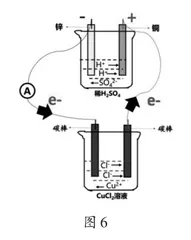
[学生活动]结合上述交流研讨,我们可以从原电池的内外电路角度分析图6所示装置,且我们知道原电池中电子从负极流出,经由外电路流入正极。请同学们基于“电子不下水,离子不上岸”原则,分析e-途径CuCl2溶液时遇到的问题。
[学生]经过分析发现,电子途经CuCl2溶液时在与电源负极相连的碳棒上富集,无法到达原电池的正极。
[教师]我们将同学们发现的问题做进一步拆解。第一,电子从原电池的负极流出,经由导线流入CuCl2溶液与电源负极相连的碳棒,由于电子无法进入溶液做定向移动,所以在碳棒上富集,如果不中和此碳棒上的电子,该装置将无法形成通路,所以我们需要解决的第一个问题是:该装置是如何中和与电源负极相连碳棒上的电子?第二,电子一定要流入原电池的正极,所以与电源正极相连的碳棒一定要放出电子,经由导线流回正极,所以我们需要解决的第二个问题是:该装置与电源正极相连的碳棒如何放出电子?请同学们思考以上两个问题,提出可能的猜想。
[学生]从物质基础角度分析,最大的可能是电子与CuCl2溶液发生相互作用。
[追问]按照同学们的思路,假设CuCl2溶液中有物质得了与电源负极相连碳棒上的电子,同时有物质在与电源正极相连碳棒上放出电子,这样的话确实就解决了我们的问题。那么,我们提出的猜想是什么?
[学生]猜想:CuCl2溶液中发生了氧化还原反应?
[设计意图]:创建学习模型,制造认知冲突,提出合理猜想,激发学习热情。
【环节三】实验验证,建构模型
[学生活动]学生分组实验。
在同学们桌面上放置着已经连接好的实验装置,现在请同学们接通电源,仔细观察实验现象,完成表1。(说明:此处电源换成了学生电源)

[教师]电解池模型建构。上述我们讨论的装置就是今天学习的电解池,现在我们已经清楚了电解池工作的原理,下面让我们一起来总结梳理电解池的工作原理(如表2)。
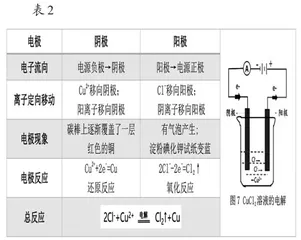
[教师]请同学们阅读教材,找出电解池的定义。
[学生]电解池是一种借助于电流引起氧化还原反应的装置,也就是把电能转变为化学能的装置,叫作电解池或电解槽。
[教师]从定义中我们可以看出,电解池就是一种装置,且是一种借助于电流引起氧化还原反应的装置,所以同学们判断一个电路是不是电解池最容易的方式?
[学生]电路中是否有电源。
[教师]电解池的能量转化形式为电能转化为化学能,与我们学习的原电池装置相反,所以我们也可以将电解池理解为一个用电器。
[设计意图]梳理探究过程,强化思维过程,落实知识目标,建构电解模型。
【环节四】拓展应用,课堂小结
电解在工业生产中有着非常重要的应用,比如我们熟知的电解法冶炼钠、镁、铝等活泼性很强的金属,除此之外还有通过电解饱和食盐水制取重要的工业原料——氯气和烧碱,再如还有电镀等等。下一课时我们将会详细地学习电解在工业中的重要应用。
[课堂小结]本课时主要的学习任务是深度理解电解池的工作原理,建构电解池认知模型。我们基于“原电池-电解池”双池模型分析,通过发现问题→提出猜想→实验验证→得出结论等一系列探究活动理解了电解池的工作原理,进而从电解池的两极、电子流向、离子定向移动、电极现象及电极反应等方面建构了电解池的认知模型,最后通过阅读教材了解电解池的定义,完成了本节课的学习任务。
五、教学反思
1.创建“原电池-电解池”双池模型有助于学生理解电解原理。本课时基于前期充分的学情分析和教材分析构建了学习模型,授课环节学生的认知困难点也同课前学情分析相吻合,在教师的语言引导下,学生理解电解池工作原理时可以自主从原电池角度进行分析,加上教师提出一系列问题,学生能够逐步达成学习目标。通过发现问题→提出猜想→实验验证→得出结论等一系列探究自主分析电解原理,且经历了完整的证据推理过程,最终培养学生的核心素养。
2.着重学生学科思维培养,落实证据推理与模型认知的核心素养。讨论电子定向移动路径时,学生发现电子无法通过CuCl2溶液到达原电池的正极,进而引起认知矛盾,为了解决这一矛盾,学生通过分析推理发现问题、提出猜想,为了验证猜想需要学生收集证据,进而培养了学生的证据推理意识。在学生理解了原电池的工作原理之后,教师通过引导学生梳理总结探究过程,帮助学生建构电解池的认知模型[3]。
3.课堂教学反思。课堂主要是以学生探究活动为主,但是问题设置开放度过大,部分学生对活动问题解读存在问题,进而导致授课过程中需要教师将问题进一步拆解才可以顺利进行,导致课堂略显烦琐。所以在今后的教学中需要反复打磨,设计适合学生认知水平的问题。
参考文献
[1]杨玉琴,倪娟.证据推理与模型认知:内涵解析及实践策略[J].化学教育(中英文),2019,40(23):23-29.
[2]朱鹏飞,陈凯,徐惠.培养学生技术素养的教学设计——以“电解池的工作原理及应用”为例[J].化学教育(中英文),2017,38(19):23-27.
[3]邵景雪.高中化学“电解池”学习困难成因分析及教学建议[D].大连:辽宁师范大学,2018.
编辑:张昀